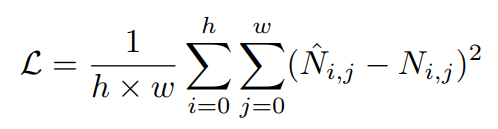羿阁 发自 凹非寺
量子位 | 公众号 QbitAI
腾讯把BERT方法用于单细胞注释技术,还登上了Nature子刊。
能辅助医生精准治癌的那种。

此次聚焦的单细胞RNA测序(scRNA-seq)技术,一直被称为生命科学领域的的革命性工具,对于“精准医疗”具有极高的应用价值。
但是,以前受制于数据样本量小、人工干预多等因素,一直难以推广使用。
这次腾讯首次将“transformer”应用到该领域,使其真正实现了高解释性、高泛化性、高稳定性。
目前,该模型已在GitHub上开源 (链接附在文末)。
新模型怎么做到的?
众所周知,人类各种组织之间细胞的类型、状态和相互作用差异巨大。
而单细胞RNA测序技术的出现,可以细粒度地观察和刻画各个物种中组织、器官和有机体中单细胞分子图谱(细胞表达),堪称给细胞中的每个基因都印上专属“身份证”。
通过这一技术,研究人员可以更好地研究这些组织及其中存在的不同类型的细胞。
更进一步地说,还可以更好地了解肿瘤微环境,以达到精细分析病因、精准匹配治疗方案的效果。
但是,受数据样本量小、人工干预多、过度依赖marker gene(已报道的特异性基因)等因素的影响,单细胞测序细胞类型注释技术一直面临着泛化性、可解释性、稳定性均比较低的问题,现存的算法也难以有更广泛的应用。
具体来说,人工注释费时、主观性强、误差大、不利于发现新的细胞类型;机器注释则经常出现在一个检测组织里有效,换到另外一个检测组织里就没效的问题,还是需要人工参与。
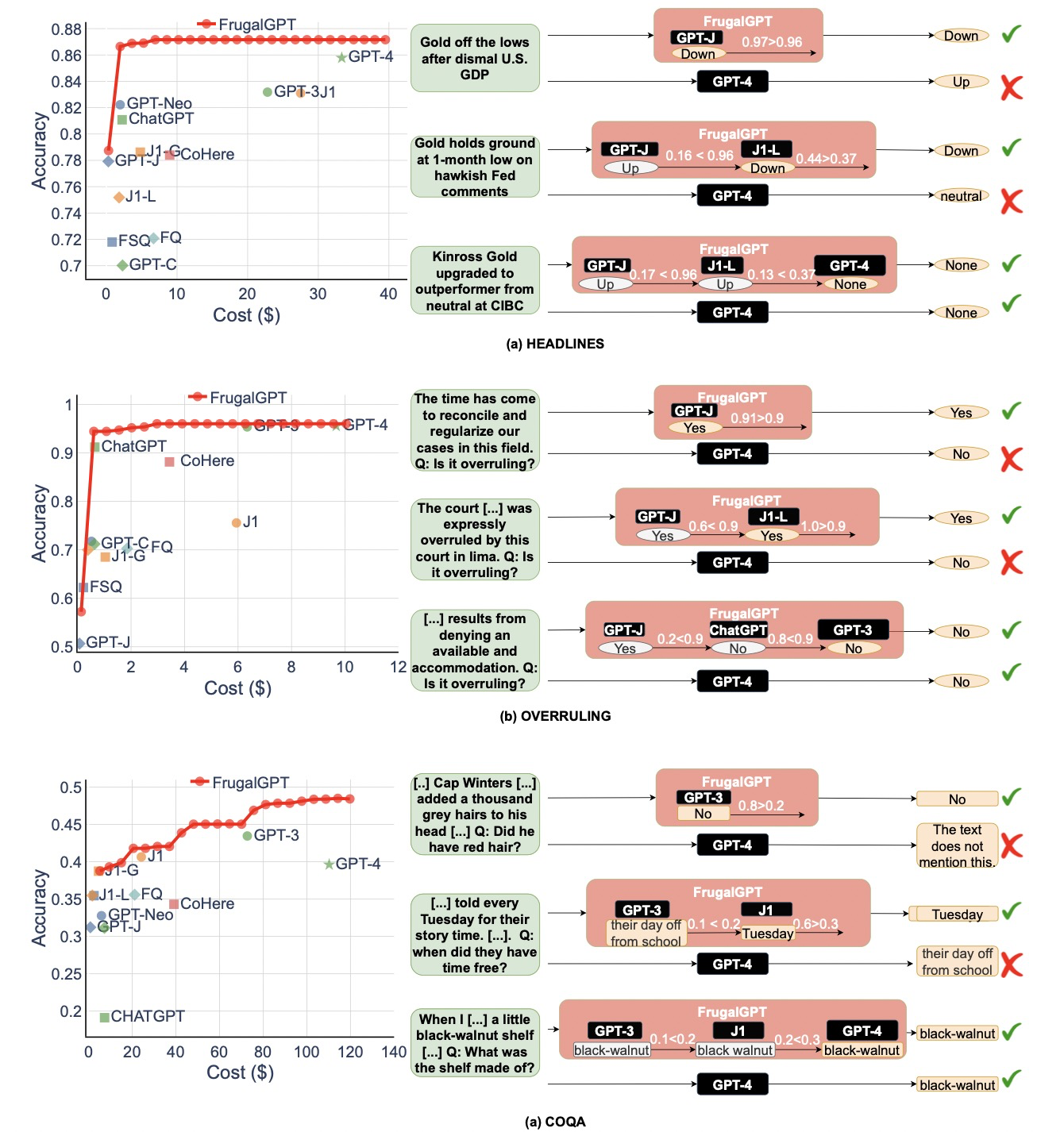
为此,研究人员开发了一种基于预训练深度神经网络的模型:scBERT模型,并首次将“transformer”运用到单细胞转录组测序数据分析领域。
scBERT模型,顾名思义是基于BERT的思路和范式。
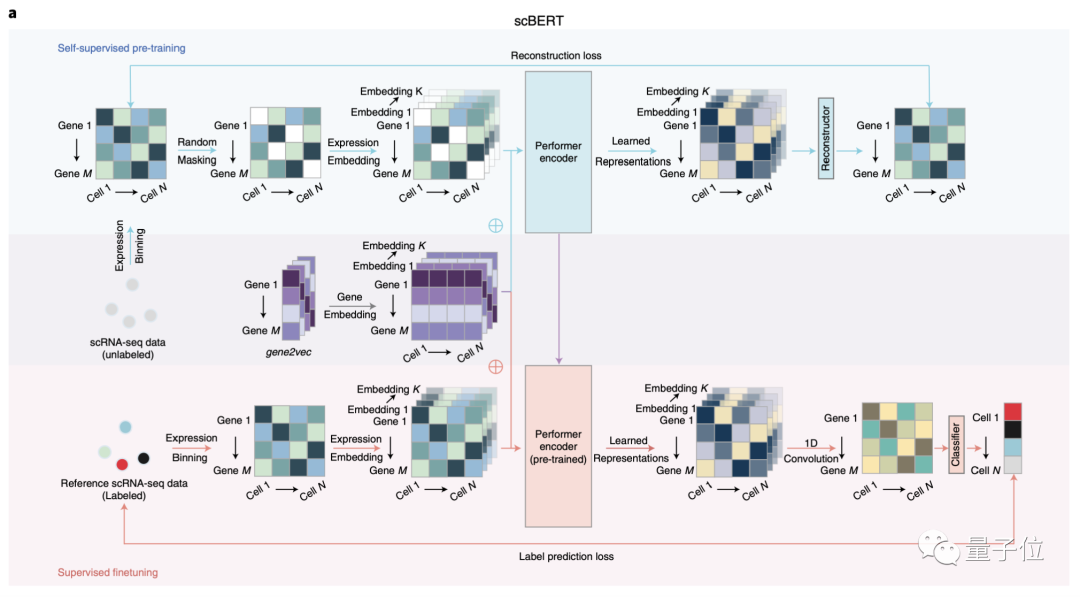
在预训练数据选择上,为了保证全基因组内基因级别的可解释性,scBERT没有做任何的降维或筛选处理,最大程度上保留数据本身的特性和信息。
此外,该模型复用了大规模的公开数据集,包含不同实验来源、批次和组织类型的单细胞数据,以保证模型能学习到更为“通用”的知识,精准捕获单个基因的表达信息及两两基因之间的作用关系。
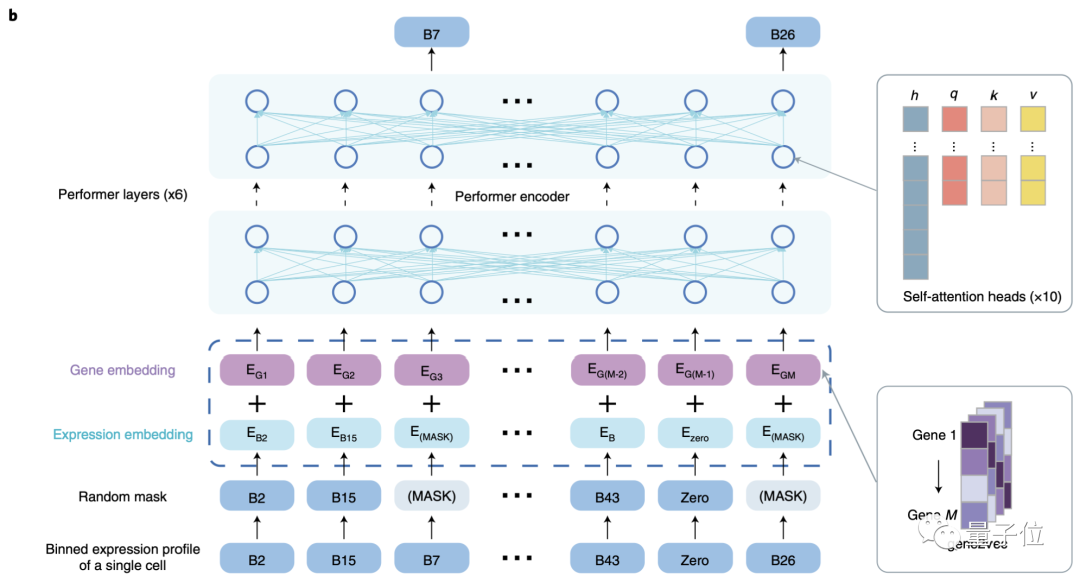
在实验中,scBERT模型也证实了其在单细胞测序上呈现出的高解释性、高泛化性、高稳定性。
截至目前,通过了9个独立数据集、超过50万个细胞、覆盖17种主要人体器官和主流测序技术组成的大规模benchmarking测试数据集上,该算法模型的优越性均得以验证。
值得一提的是,在极具挑战的外周血细胞亚型细分任务上,相较现有最优方法的70%准确度提升了7%。

不仅如此,这一技术的突破在实际应用中也有很重要的价值:
未来可用于临床单细胞测序数据,并辅助医生描述准确的肿瘤微环境、检测出微量癌细胞,从而实现个性化治疗方案或者癌症早筛。
同时,对疾病致病机制分析、耐药性、药物靶点发现、预后分析、免疫疗法设计等领域都具有极其重要的作用。
研究团队
研究团队主要来自腾讯AI Lab,共同一作有三位:Fan Yang、Wenchuan Wang和Fang Wang。
研究人员称,未来他们会继续基于自身先进AI技术的积累,与下游临床、制药和生命科学基础研究领域进行密切合作。
GitHub链接和论文链接放在文末,感兴趣的小伙伴可以自取~
GitHub链接:
https://github.com/TencentAILabHealthcare/scBERT
论文链接:
https://www.nature.com/articles/s42256-022-00534-z#Abs1