越来越多的证据表明,铁死亡参与了帕金森病(PD)的进展。本研究旨在探讨铁死亡相关基因(FRGs)、免疫浸润和免疫检查点基因(ICGs)在帕金森病发病和发展过程中的作用。
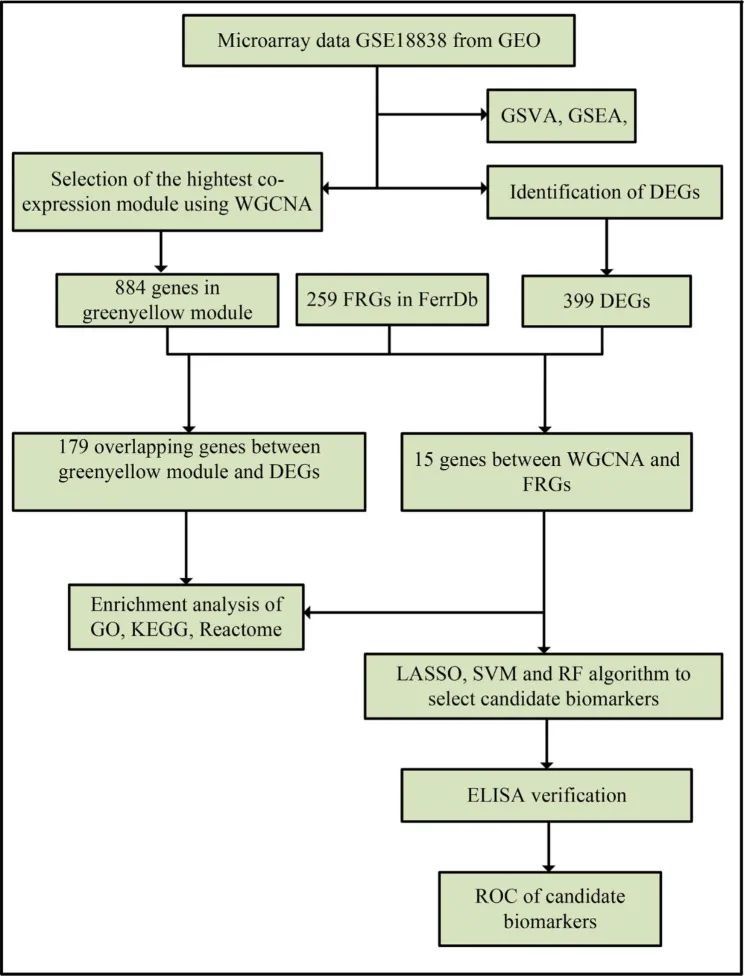
图1 流程图
1. 识别关键的 WGCNA 模块和 DEGs
聚类分析后,没有样本被剔除。基于 GSE18838 数据集构建了 WGCNA 网络,以确定与 PD 相关的有意义的基因模块。选择软阈值功率为 12,无标度拓扑拟合指数 R^2 达到 0.84,平均连接度为 18.10,表明无标度网络已经建立(图 2A,B)。通过动态树切割法确定共表达基因模块,合并相似模块后,根据 MEDissThres = 0.25 进一步筛选出关键模块(图 2C,D)。然后作者分析了关键模块与临床表型之间的关系,并显示了关键模块中所有基因的热图(图 2E,F)。在分析的10个模块中,黄绿色模块与帕金森病的临床特征显著相关,被选为关键模块(cor = 0.49, p = 0.008, 图2E)。按照 q.weighted < 0.05 的标准,作者选择了 884 个基因进行后续研究。此外,作者还观察到 PD 与黄绿色模块之间的高度相关性(cor = 0.492),而黄绿色模块中的模块成员(MM)与基因重要性(GS)之间的相关性为 0.28(cor = 0.28,p = 2.3e-07,图 2G)。
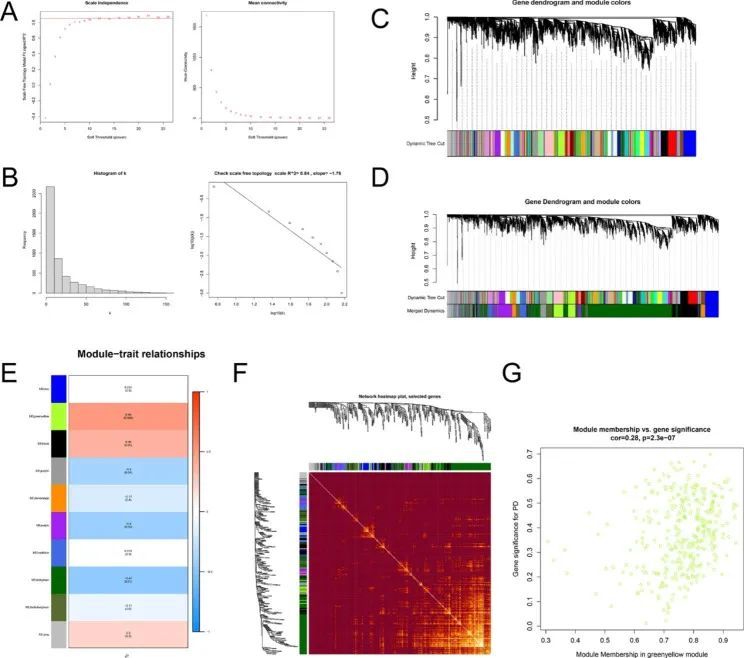
图2 WGCNA 网络和模块检测
此外,通过 PCA 和不同表达分析,作者得到了 399 个 PD 和 HC 样本之间的 DEGs(图 3A,B)。通过 Venn 图(图 3C),作者筛选出了 15 个与铁突变相关的 WGCNA 基因和 179 个 WGCNA-DEGs。
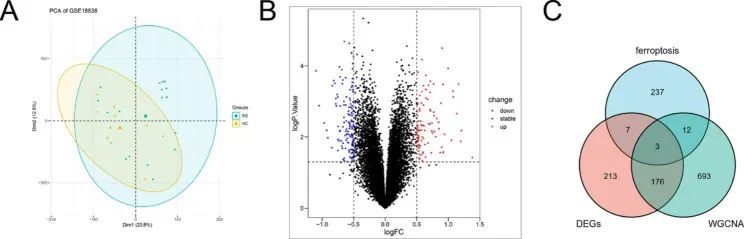
图3 基因芯片的 PCA 图和不同表达基因的火山图
2.GSEA 和 GSVA
作者进行了 GSEA 和 GSVA 分析,以筛选 PD 和 HC 之间的生物学差异。图 4A、B、C 显示了 GO-BP、GO-CC 和 GO-MF 的富集分析结果。以KEGG和标志基因集为参考集,GSVA富集分析发现PI3K-AKT-mTOR信号通路、活性氧通路、P53信号通路和自噬调控参与了PD的发病机制(图4D, E)。作者还发现一些相关的免疫学通路在 PD 和 HC 之间明显富集(图 4F)。此外,KEGG通路的GSEA分析发现了PD的一些潜在通路,如自噬、细胞凋亡、坏死、NOD样受体信号通路、TNF信号通路、泛素介导的蛋白水解、细胞衰老、有丝分裂、帕金森病、酒精性肝病和中性粒细胞胞外陷阱的形成。
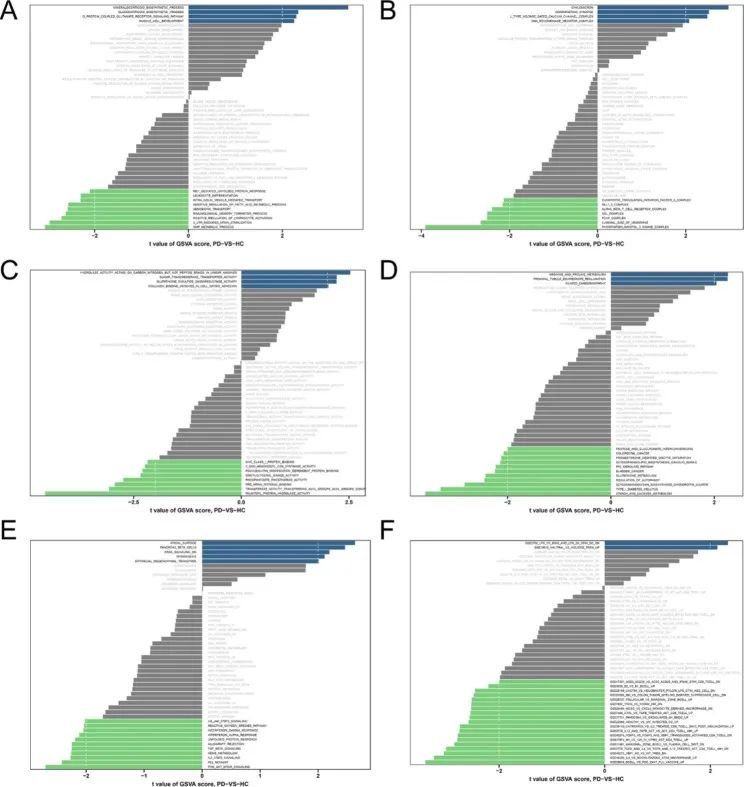
图4 GSVA 不同参考基因集的结果
3.通过机器学习方法筛选出的候选基因
作者使用LASSO逻辑回归算法从15个铁蛋白相关-WGCNA基因中筛选出8个基因作为PD的关键生物标志物(图5A),同时使用RF和SVM-RFE算法筛选候选基因(图5B,C)。通过三种算法得到的重叠基因被认为是候选生物标志物,最终 LPINI 和 TNFAIP3 这两个基因被认为是生物标志物(图 5D)。图 6A, B 显示了对两个特征基因进行 GSEA 分析的 KEGG 通路。LPINI涉及酒精性肝病,TNFAIP3主要与Epstein-Barr病毒感染、麻疹、坏死、NOD样受体信号通路和TNF信号通路有关。为了进一步检验 LPINI 和 TNFAIP3 对 PD 的诊断效果,作者分析了这两个基因的表达水平,并通过 GSE18838 微阵列表达矩阵进行了验证。结果发现,这两个基因在 PD 全血中均呈下调表达,且 ROC 曲线显示这两个基因具有更好的诊断潜力,LPINI 和 TNFAIP3 的 AUC 分别为 0.872(95% CI:0.723-1.000)和 0.818(95% CI:0.647-0.989)(图 6C,D)。此外,还将 GSE72267 作为验证数据集,其中包括 40 例 PD 患者和 20 例健康对照。在 NetworkAnalyst 上建立了 LPIN1 和 TNFAIP3 的 TF-miRNA 核心调控网络(图 6E)。
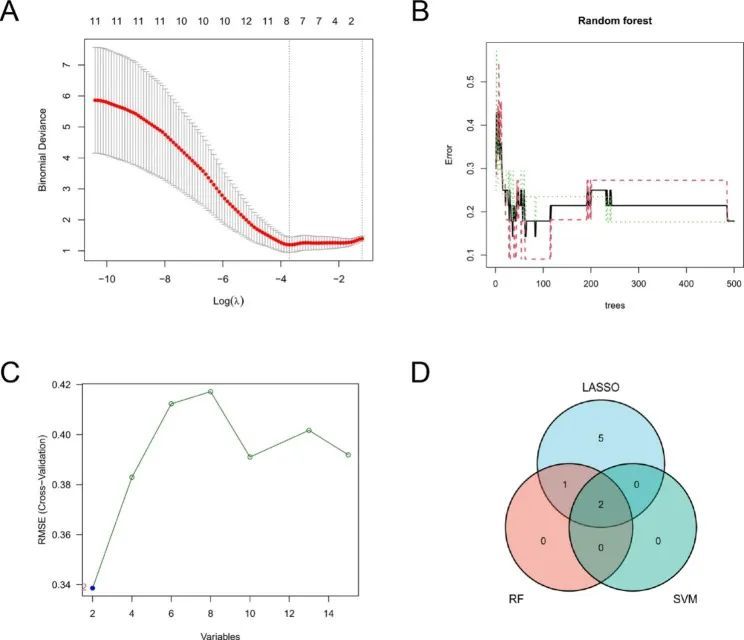
图5 使用机器学习方法识别与诊断相关的候选基因
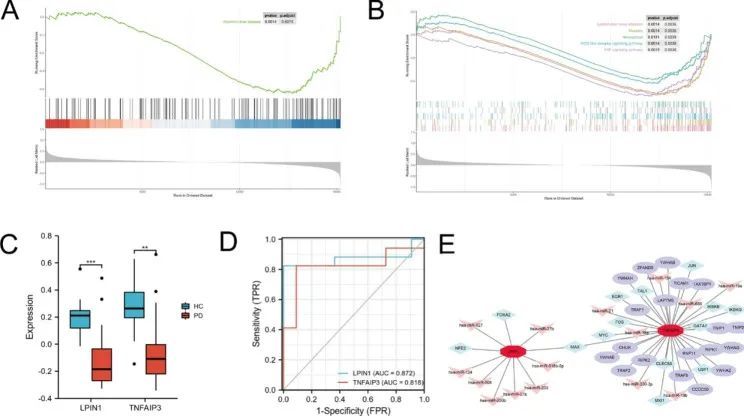
图6 候选基因的 KEGG 通路和 GSE18838 数据集的验证
4.GO 和 KEGG 分析
为说明 179 个 WGCNA-DEG 的功能注释,进行了 GO 分析。细胞组成的 GO 分析结果如图 7A 所示。在生物过程类别中,最富集的 GO 术语是线粒体呼吸复合体 I 组装、自噬的正向调节、对活性氧的反应和 T 细胞活化/分化;在分子功能类别中,最富集的 GO 术语是 NADH 脱氢酶(泛醌)活性、MHC 蛋白结合、免疫受体活性和 ATP 代谢过程、Ras 蛋白信号转导、对活性氧的反应和 I-kappaB 激酶/NF-kappaB 信号转导的正向调节等(图 7B,C)。7B, C)。为了研究相关的信号通路,作者进行了 KEGG 和 Reactome 分析。在 Reactome 通路中,大自噬、MHC II 类抗原呈递、脂质代谢、类收费受体级联和细胞对应激的反应参与了 PD(图 7D)。此外,KEGG通路分析还显示,溶酶体、FoxO信号通路、糖尿病心肌病和癌症中的PD-L1表达及PD-1检查点通路可能与帕金森病有关(图7E)。
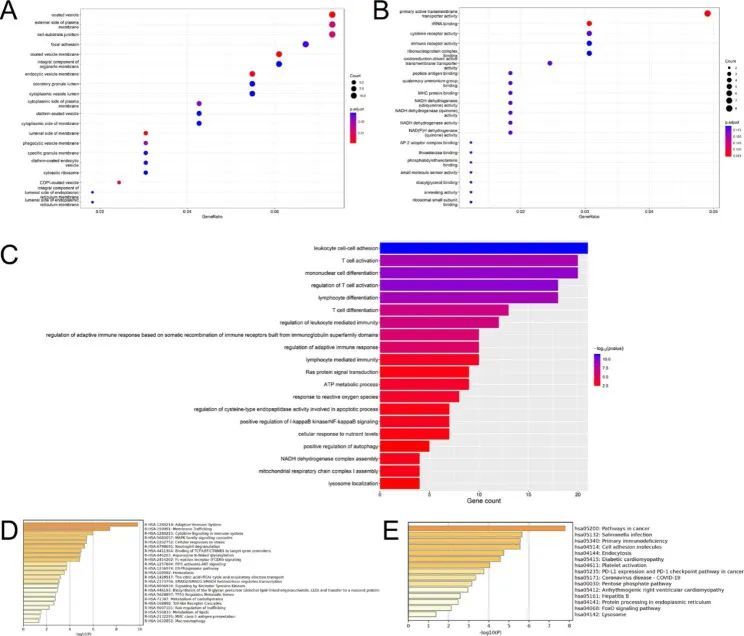
图7 WGCNA-DEG 的 GO 和 KEGG 通路富集结果
在15个铁死亡-WGCNA基因中,显著富集的GO术语表明,细胞对TOR信号转导的反应、p53类介质的信号转导、选择性自噬、对活性氧或金属离子或氧化应激的反应、脂肪酸代谢过程和神经元死亡与铁死亡和PD相关。KEGG结果表明,mTOR信号通路、细胞衰老、中性粒细胞胞外陷阱形成、神经变性-多种疾病通路、NF-kappa B信号通路等可能在PD中发挥重要作用。
5.浸润免疫细胞的估计和相关分析
首先,作者使用 "CIBERSORT "算法,利用28个样本的基因矩阵估算了22种浸润性免疫细胞的比例。与HC的结果相比,PD样本中幼稚B细胞、浆细胞、幼稚CD4 T细胞、调节性T细胞、巨噬细胞M0和巨噬细胞M1的比例明显降低,而记忆B细胞、γδT细胞和静息树突状细胞的比例明显升高(图8A)。通过矛曼分析发现,候选基因与浸润免疫细胞之间存在正相关和负相关关系。LPINI 与幼稚 B 细胞、浆细胞和幼稚 CD4 T 细胞呈正相关,而与记忆 B 细胞、γ δ T 细胞和静息树突状细胞呈负相关。TNFAIP3 与幼稚 B 细胞、幼稚 CD4 T 细胞、调节性 T 细胞、巨噬细胞 M0 和巨噬细胞 M1 呈正相关,而与γ-δ T 细胞和静息树突状细胞呈负相关(图 8B)。
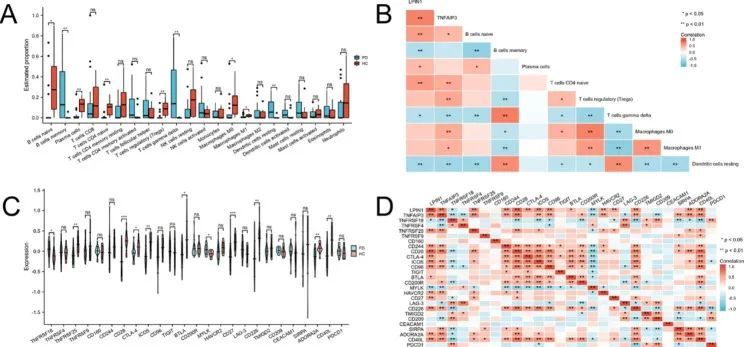
图8 免疫细胞浸润状况和免疫检查点基因的表达
此外,在T细胞上表达的免疫检查点基因中,TNFRSF18、TNFRSF25、CD28、CTLA-4、ICOS、BTLA、MYLK、CD27、CD226、ADORA2A和CD40L在两组间存在显著差异(图8C)。候选基因与免疫检查点基因的相关性分析见图 8D。LPIN1与上述所有不同的ICG都有明显的相关性,但TNFAIP3仅与TNFRSF18、TNFRSF25、CD28、ICOS、MYLK、CD226、ADORA2A和CD40L有相关性。
6.帕金森病患者和健康对照组的人口统计学和临床特征
健康对照组和帕金森病患者的 RBC、Hb、Hct、单核细胞和淋巴细胞比例有显著差异(P = 0.000、P = 0.000、P = 0.000、P = 0.031)。此外,HC 和早期 PD 患者的白细胞、红细胞、血红蛋白、血色素 Hct 的差异也有统计学意义(P = 0.031、P = 0.000、P = 0.000、P = 0.000)。早期和中晚期 PD 患者的年龄、病程(年)、MDS-UPDRS Ⅲ"关 "评分、白细胞、中性粒细胞(%)、淋巴细胞(%)、中性粒细胞与淋巴细胞比值、单核细胞与淋巴细胞比值也有统计学差异(P = 0.002、P = 0.000、P = 0.000、P = 0.026、P = 0.003、P = 0.001、P = 0.002、P = 0.031)。早期和中晚期帕金森病患者的UPDRS评分有明显差异,这与两期的疾病程度相符。
7.帕金森病患者和健康对照组的 LPIN1 和 TNFAIP3 血浆水平
PD患者LPIN1的血浆浓度(105.7 ng/mL [range 56.98 to 161.3 ng/mL])明显低于HC患者(121.0 ng/mL [range 87.03 to 773.4 ng/mL])(p < 0.0001)(图9A)。与HC(20.50 pg/ml [range 5.84 to 159.5 pg/ml])相比,PD患者的TNFAIP3血浆浓度(45.91 pg/ml [range 4.61 to 193.9 pg/ml])明显升高(p < 0.0001)(图9B)。当把PD患者分为早期和中晚期时,早期PD患者血浆中LPIN1的水平(101.7 ng/mL [range 77.96 to 137.7 ng/mL])明显低于HC患者(p < 0.0001),而早期和中晚期PD患者血浆中LPIN1的水平(110.0 ng/mL [range 56.98 to 161.3 ng/mL])差异无统计学意义(p = 0.2806)(图9C)。与HC相比,早期PD患者的TNFAIP3水平(35.06 pg/mL [range 4.61 to 135.2 pg/mL])明显升高(p = 0.0407),早期PD患者与中晚期PD患者的TNFAIP3水平(50.63 pg/mL [range 7.75 to 193.9 pg/mL])也存在明显差异(p = 0.0459)(图9D)。TNFAIP3 与年龄、嗜碱性粒细胞、Hoehn 和 Yahr 量表、疾病分期的相关性较弱。
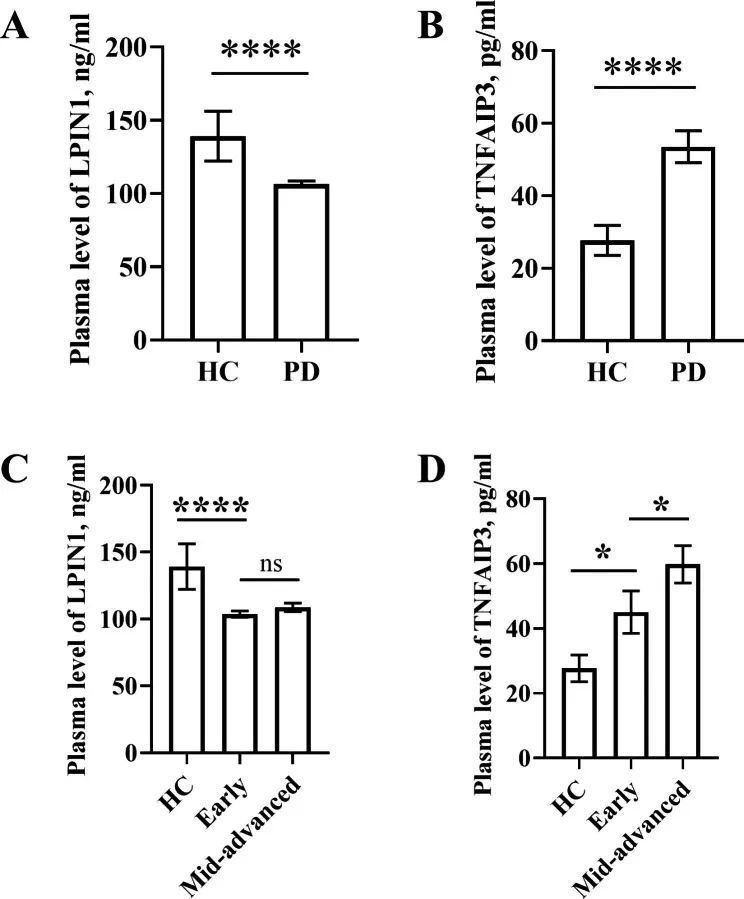
图9 两种生物标记物的 ELISA 验证
8.浆液性 LPIN1 和 TNFAIP3 在帕金森病中的诊断价值
应用接收者操作特征曲线(ROC)评估了LPIN1和TNFAIP3在PD中的潜在诊断价值。LPIN1和TNFAIP3对PD的ROC曲线下面积(AUC)分别为0.754(95% CI:0.659-0.849,p<0.0001,敏感性=0.771,特异性=0.692)和0.754(95% CI:0.660-0.849,p<0.0001,敏感性=0.686,特异性=0.821)(图10A)。在区分早期PD和HC时,LPIN1和TNFAIP3的AUC分别为0.817(95% CI:0.717-0.917,p<0.0001,灵敏度=0.867,特异性=0.692)和0.650(95% CI:0.507-0.794,p=0.040,灵敏度=0.667,特异性=0.718)(图10B)。然而,LPIN1 和 TNFAIP3 在区分早期和中晚期 PD 患者方面表现不佳(LPIN1:AUC = 0.599,95% CI:0.465-0.733,p = 0.146;TNFAIP3:AUC = 0.647,95% CI:0.510-0.783,p = 0.035)(图 10C)。然后,作者使用逻辑回归分析,结果表明 LPIN1 和 TNFAIP3 的组合预测效果更好(HC vs. PD,AUC = 0.833,95% CI:0.750-0.916,p < 0.0001;HC vs. 早期 PD,AUC = 0.831,95% CI:0.734-0.927,p<0.0001)(图 10D、E),而对早期和中晚期 PD 的诊断效果相对较差(AUC = 0.637,95% CI:0.505-0.768,p = 0.041)(图 10F)。
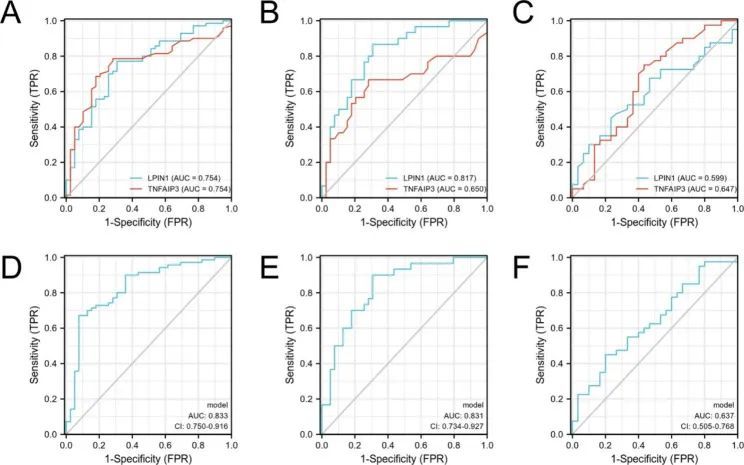
图10 两种生物标记物的 ROC
总结
综上所述,作者的研究结果证实,PD血浆中LPINI和TNFAIP3的异常低表达或上调、铁败细胞和循环免疫系统反应与PD的发病机制有关。此外,铁突变相关基因与免疫检查点基因、免疫浸润等也有相关性。因此,该研究进一步加深了人们对嗜铁细胞对外周血单核细胞(主要包括淋巴细胞和单核细胞)影响机制的认识。然而,LPINI和TNFAIP3调控PD中铁死亡和免疫的具体机制尚不清楚。要探索LPINI和TNFAIP3对外周免疫细胞的生物学效应,并为PD提供可靠的临床诊断标志物,还需要更多的研究。