今天给同学们分享一篇生信文章“CENPF/CDK1 signaling pathway enhances the progression of adrenocortical carcinoma by regulating the G2/M-phase cell cycle”,这篇文章发表在J Transl Med期刊上,影响因子为7.4。

结果解读:
CENPF在ACC中过表达,但在肾上腺皮质腺瘤或正常肾上腺皮质组织中不表达
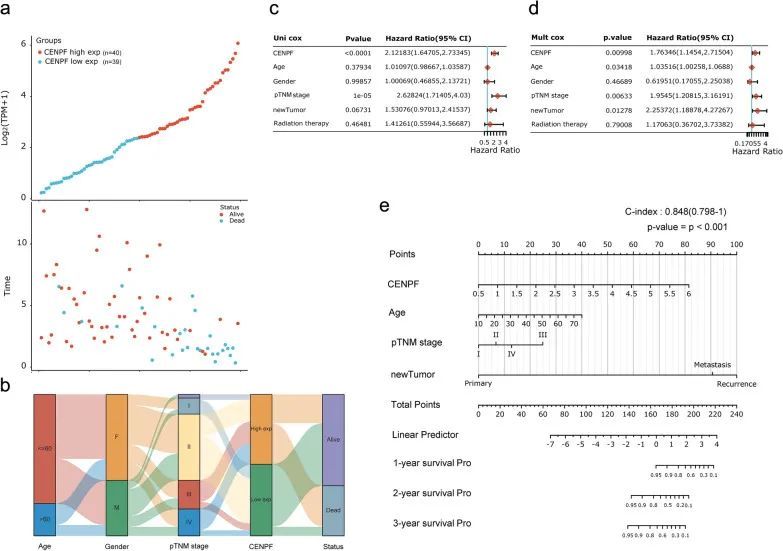
正常肾上腺皮质、肾上腺皮质腺瘤(良性肿瘤)和ACC(恶性肿瘤)在形态学和组织学上存在显著差异。首先,大体标本摄影显示肾上腺皮质腺瘤的结节切片呈金黄色,质地坚硬;对于ACC,包膜完整或有缺陷,一些区域呈灰红色,坏死(图第1a段)。IHC-P结果显示,与肾上腺皮质腺瘤或正常肾上腺皮质组织相比,ACC中CENPF大多上调,但肾上腺皮质腺瘤和正常组织之间没有显著差异(P < 0.001,图1b,c)。此外,这些结果在公共数据库中得到了验证,包括GEO和TCGA数据集,用于ACC患者。CENPF的mRNA表达在GSE90713中显著过表达(p < 0.01,图1d)。但有趣的是,该基因在GSE19750中的表达没有显著差异(p = 0.11,图1e)。这可能是在正常肾上腺皮质组织样本量过小的情况下(n = 4) 。同时,这场争论也吸引了作者进一步探究。此外,GEPIA数据库的相关性分析显示,与正常肿瘤相比,CENPF的mRNA表达在ACC肿瘤中明显过表达(p < 0.001,图1f),并且与ACC的肿瘤分期呈正相关(p < 0.001,图1g)。

此外,Ki67作为细胞增殖指标在ACC中进行了研究。根据Ki67阳性细胞在ACC中的比例,进一步讨论了CENPF的表达与细胞增殖之间的关系。结果,CENPF的表达,即CENPF阳性细胞的比例,与Ki67阳性细胞的比率呈正相关(p = 0.008,R = 0.85,图2a,b)。此外,基于TCGA-ACC数据集,CENPF的表达与MKI67的表达呈正相关(p = 0,R = 0.91,图2c)。提示CENPF的表达与ACC患者的细胞增殖密切相关。

CENPF在ACC患者临床病理参数中的分析
为了弄清楚ACC中CENPF表达与临床病理参数之间的相关性,将所有ACC患者分为两个亚组,根据中位数截断值,包括39个CENPFlow和40个CENPFhigh样本(图第3a段)。如表所示表1,1,CENPF的表达与年龄、性别、偏侧性和米托坦治疗无关(p > 与CENPFlow相比,CENPFhigh的ACC患者的病理分期明显晚期(尤其是III期和IV期,p < 0.001)。在肿瘤状态、新事件或残留肿瘤方面,CENPFhigh的ACC病例比CENPFlow更容易失去手术、复发或形成残留肿瘤的机会(p < 0.001)。此外,CENPFhigh组的Weiss评分更高(尤其是Weiss评分6-9,p = 0.002)。此外,血图描述了CENPF在年龄、性别、pTNM阶段和地位方面的分布(图第3b段)。此外,通过单因素和多因素回归分析,确定了CENPF与ACC患者OS的相关临床参数(包括年龄、性别、pTNM分期等)之间的相关性。结果,在单因素分析中,CENPF表达和pTNM分期与ACC患者的OS密切相关(图3c,所有p < 0.05),并且CENPF表达和pTNM分期可以在多因素分析中作为ACC患者的独立预后因素(图3d,所有p < 0.05)。最后,通过Nogram评估一名ACC患者与CENPF高表达相关的1年、2年或3年的生存率(图第3e段)。
过度表达CENPF与ACC患者的较差生存率相关
根据生存率分析,CENPF表达上调预测OS(HR = 8.66,对数秩p = 1.8e−05;图4a)和PFS(HR = 4.11,对数秩p = 6.68e−05;图4c)。ROC曲线分析表明,CENPF在OS的1年、3年和5年的AUC(图3b)和PFS(图3d)指出,CENPF的表达对ACC的预后具有良好的预测作用(所有AUC值 > 0.75)。此外,亚组分析表明,ACC患者中CENPF的过度表达是30个月、60个月和120个月OS的危险因素(所有log秩均为p ≤ 0.001,图4e–g)。

GSEA分析揭示CENPF在肿瘤发生和发展中的隐蔽分子机制
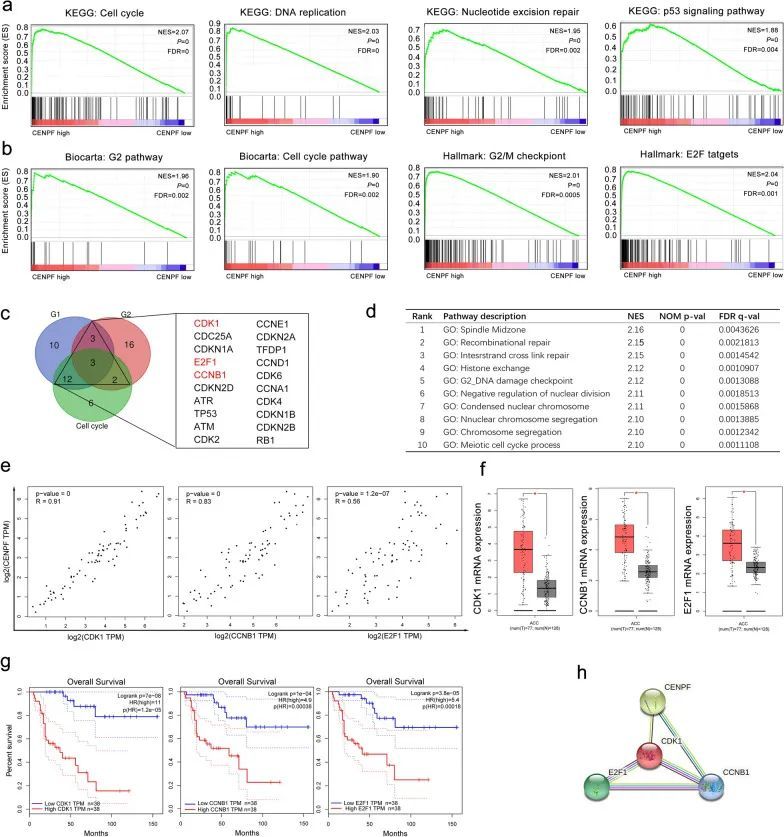
为了揭示CENPF在癌症相关信号通路中的潜在作用,进行了GSEA来解释具有CENPFlow和CENPFhigh的ACC样品的基因表达谱。根据KEGG通路的GSEA分析,CENPFhigh患者主要富集在细胞周期、DNA复制、核苷酸切除修复和p53信号通路等方面(图5a)。然后,对Biocarta通路的GSEA富集分析和Hallmark描述表明,细胞周期(NES = 2.03,p = 0;尤其是有丝分裂的G2期 = 1.96,p = 0),G2/M检查点(NES = 2.01,p = 0)和E2F目标(NES = 2.04,p = 0)在具有CENPFhigh的ACC患者中大多富集,这意味着CENPF可能通过与E2Fs蛋白相互作用来调节细胞周期(图5b)。此外,相关研究表明,E2F1在NCI-60细胞系中发挥CENPF转录因子的作用[43],并调节G2/M期转变的细胞周期。因此,作者认为CENPF可能通过与ACC中的E2F1相互作用来调节细胞周期。Venn图表明,20个基因(CDK1、CDC25A、CDKN1A、E2F1、CCNB1、CDKN2D、ATR、TP53、ATM、CDK2、CCNE1、CDKN2A、TFDP1、CCND1、CDK6、CCNA1、CDK4、CDKN1B、CDKN2B和RB1)在至少两组中共表达(图5c)。据报道,CENPF主要调节有丝分裂中的纺锤体分离[46]。“主轴中间区域”是GESA GO术语分析中的前1个术语。通过筛选这20个基因的相关性、表达和预后,作者发现CDK1、CCNB1和E2F1在ACC样本中与正常样本相比大多过表达(图5f,所有p < 0.05),并且与CENPF的表达呈正相关(图5e,所有p < 0.01)。过表达的CDK1、CCNB1和E2F1也与ACC患者的阴性OS有关(图5g,所有p < 0.01)。此外,PPI网络显示,CENPF、CDK1和CCNB1之间存在密切的相互作用(图5小时)。因此,这表明CENPF通过与ACC中的CDK1、E2F1和CCNB1相互作用来调节细胞周期。过表达的CENPF可能在ACC进展中的G2/M期过渡介导的细胞周期的调节中发挥关键作用。
CENPF干扰对SW13细胞周期调控的影响
为了进一步探索CENPF在ACC中的作用,通过ACC细胞系人SW13细胞进行CENPF siRNA(siCENPF),作为体外实验。与siNC相比,在siCENPF中CENPF的表达被明显抑制。图6a,b)。在细胞增殖测定中,CENPF干扰明显抑制了细胞增殖(图6c)和细胞迁移(图6d),在细胞转染48小时后,在人SW13细胞中。CENPF的抑制明显降低了肿瘤细胞和基质之间的粘附(图6e)和人SW13细胞中的细胞侵袭(图6f)。此外,流式细胞术测定表明,CENPF的下调明显增强了细胞凋亡,包括细胞凋亡的早期和晚期(18.46%对36.56%,图6g)。然后,CENPF干扰诱导人SW13细胞在G2/M期转变时的细胞周期停滞(28.2%对6.4%,图6h)。如图5所示,CENPF的表达与ACC中的CDK1密切相关。因此,SiCDK1被设计用于探测CENPF和CDK1之间的相关性(附加文件9:图S1a,b)。CDK1的下调显著抑制细胞增殖(附加文件9:图S1c)和细胞迁移率(图6d)。细胞转染48小时后,CDK1的上调显著抑制肿瘤细胞和基质之间的粘附(图6e)和人SW13细胞中的细胞侵袭(图6f)。此外,流式细胞术实验显示,CDK1的下调明显增强了细胞凋亡,包括细胞凋亡的早期和晚期(18.46%对28.5%,图6g)。最后,CDK1干扰阻断了人SW13细胞G2/M期转变的细胞周期(28.2%对16.2%,图6小时)。

CENPF调节人SW13细胞CDK1表达和p53信号传导
在SW13细胞中进一步探讨了CENPF的分子机制。如图6所示,CENPF表达的抑制导致CDK1表达的降低(图6i),而CDK1的抑制对CENPF的表达没有显著影响(图6j)。提示CENPF可能调节CDK1的表达。此外,GSEA富集分析揭示了p53信号通路可能是CENPF参与人类ACC发生和发展的一种被掩盖的分子机制(图第5a段)。因此,通过Western印迹检测SW13细胞中p53(P-p53)的磷酸化、p53、p21和Bax的表达水平。由于siRNA干扰CENPF和CDK1,在SW13细胞中,与siNC相比,P-p53、p21和Bax的表达水平显著降低(图6i,j)。因此,CENPF的抑制下调了CDK1的表达,抑制了p53的磷酸化,并改变了下游蛋白水平,包括细胞凋亡和细胞周期相关蛋白。
ACC治疗的潜在治疗策略
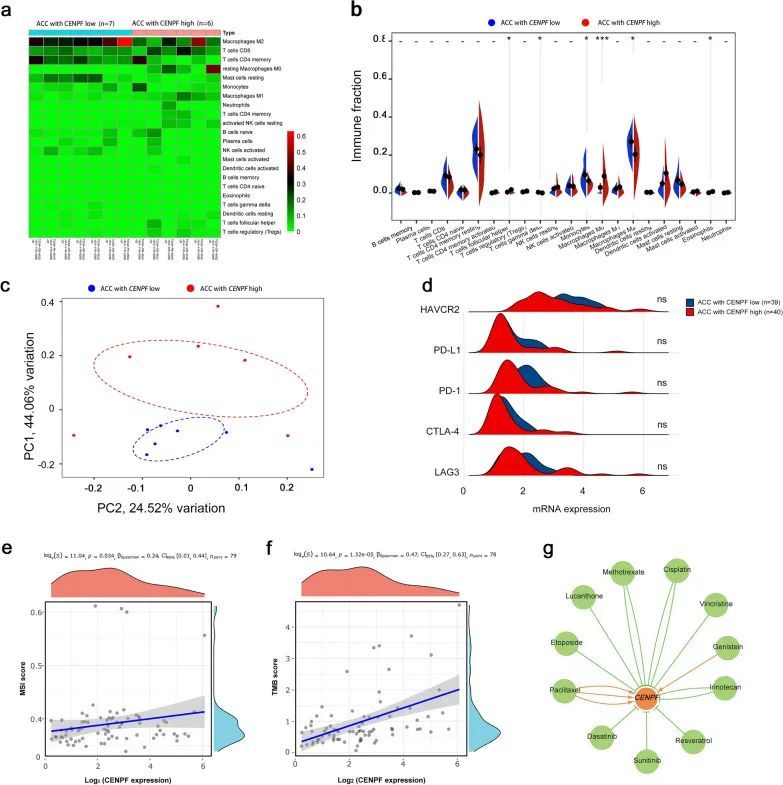
接下来,进一步探索了可能有利于ACC治疗的可用化学药物和治疗策略,包括免疫疗法。首先,分析CENPFhigh和CENPFlow对ACC免疫细胞浸润的影响,探讨免疫疗法。TCGA数据库中的所有79个ACC组织被分为两组,其中40个CENPFhigh组织和39个CENPFlow组织的中位数。应用CIBERSORTx分析免疫细胞浸润,包括22种CENPF低表达和高表达的细胞类型。p < 0.05具有统计学意义。通过“Limma”包装标准化,然后过滤组,包括7个CENPFlow和6个CENPFhigh ACC组织,进行进一步分析。每个样本的22个免疫细胞群的表达以热图的形式呈现(图第7a段)。免疫富集评分在6个CENPFhigh和7个CENPFlow样本之间有显著差异。如图6所示,7b,与CENPFlow组相比,CENPFhigh组的ACC中主要富集卵泡辅助T细胞、M0巨噬细胞、嗜酸性粒细胞。然而,与CENPFlow组相比,CENPFhigh组的γ-ΔT细胞、单核细胞和M2巨噬细胞的免疫富集得分要低得多。主成分分析(PCA)显示,CENPFhigh和CENPFlow-ACC样本之间的免疫浸润存在明显差异(图第7c段)。这可能表明CENPF的免疫异质性在ACC患者中是显著的。另外,LAG3、CTLA4、PD-1、PD-L1和HAVCR2的mRNA表达与肿瘤免疫抑制或耐受性密切相关,与CENPFlow相比,CENPFhigh的ACC中LAG3、CTRA4、PD-1和HAVCR2的mRNA表达没有显著差异(图7d,所有p > 0.05)。此外,分析了CENPF的表达与MSI或TMB之间的相关性,发现CENPF表达与MSI评分显著相关(图7e,p = 0.034)和TMB评分(图7f,p < 0.01)。这表明CENPF的过表达可能会增加ACC中DNA复制过程中异常基因突变即TMB的积累。然后,基因-药物相互作用网络表明,多种药物可能会影响CENPF在mRNA或蛋白质水平上的表达水平(图第7g段)。例如,顺铂、舒尼替尼和依托泊苷可以抑制CENPF的表达水平,而紫杉醇和金雀异黄素可以诱导CENPF表达水平。一般来说,所有这些CENPF抑制剂都被认为是治疗ACC的潜在靶点。
总结
总之,本研究指出CENPF在ACC患者中显著过表达。过度表达的CENPF预测ACC的预后不良,并可能增加ACC的进展。结果表明,CENPF可能被视为ACC患者的预后生物标志物或治疗靶点。根据体外实验,CENPF的过表达上调了CDK1,介导了G2/M期转变、细胞增殖、细胞迁移、细胞侵袭以及TMB和MSI的积累。此外,CENPF的过表达可能激活p53信号通路,从而发挥潜在的抗肿瘤作用。总之,该研究强调了关于CENPF和相关信号通路的积累证据,这可能为开发CENPF介导的治疗药物或制定ACC患者个体化治疗策略提供有益的启示。



![[vue-router]vue3.x Hash路由前缀问题](https://img-blog.csdnimg.cn/7e8e9690990a4ea28ef024c88b94e21c.png)