小罗碎碎念
今天要分享的文献主题,大家一定非常熟悉,因为绝大多数AI4cancer的文章都会提到它——预后预测,所以今天的文献主题是——人工智能+肿瘤预后预测。

在正式开始分享之前,我想先带着大家梳理两个问题。解决了以下两个问题以后,你会对今天推文有更深刻的认知。
问题梳理
问题1:肿瘤预后具体指什么
肿瘤预后是指根据临床经验预测的肿瘤发展情况,它涉及对肿瘤的临床表现、化验及影像学、病因、病理、病情规律等方面的了解,并结合治疗时机和方法,以及治疗过程中发现的新情况,对肿瘤的近期和远期疗效、转归恢复或进展程度的评估。
预后的好坏与多种因素有关,包括患者的治疗时机、疾病的严重程度、医学水平、合并疾病、医生的个人能力、患者的体质、年龄、对疾病的认知能力以及是否继续治疗等。这些因素即使在接受相同治疗的情况下,也导致预后出现很大的差异。
问题2:肿瘤预后疗效指标有哪些
肿瘤预后疗效指标主要包括以下几类:
-
总生存期(Overall Survival, OS):从随机分组开始至患者因任何原因死亡的时间。OS被认为是肿瘤临床试验中最佳的疗效终点,因为它直接反映了患者的生死情况。
-
客观缓解率(Objective Response Rate, ORR):肿瘤体积缩小达到预先规定值并能维持一定时间的患者比例,通常包括完全缓解和部分缓解的比例之和。
-
无进展生存期(Progression-free Survival, PFS):从随机分组开始到肿瘤发生进展或任何原因死亡之间的时间。PFS能较早地反映治疗效果,并且随访时间较短。
-
疾病进展时间(Time to Progress, TTP):从随机分组开始到肿瘤发生进展的时间。TTP主要关注肿瘤的恶化情况,不包括死亡。
-
无病生存期(Disease-free Survival, DFS):从随机分组开始至疾病复发或任何原因死亡之间的时间。DFS常用于根治性手术或放疗后的辅助治疗研究。
-
治疗失败时间(Time to Treatment Failure, TTF):从随机分组开始至退出试验的时间,退出原因包括患者拒绝、疾病进展、患者死亡或不良事件等。
-
缓解持续时间(Duration of Response, DoR):从肿瘤第一次评估为缓解开始到第一次评估为疾病进展或死亡的时间。
-
疾病控制时间(Duration of Disease Control, DDC):从肿瘤第一次评估为CR、PR或SD开始到第一次评估为PD或死亡的时间。
-
疾病控制率(Disease Control Rate, DCR):肿瘤缩小或稳定且保持一定时间的患者比例,包括CR、PR和SD的患者。
-
临床获益率(Clinical Benefit Rate, CBR):达到CR、PR或SD的患者比例。
-
患者报告结果(Patient Reported Outcome, PRO):包括健康相关生活质量、健康状态测量工具、患者满意度和治疗体验、心理困扰、疼痛和自我效能评价等。
-
免疫评分(Immunoscore):基于肿瘤微环境中免疫细胞的浸润程度和类型的评分系统,用于评估肿瘤患者的预后及治疗疗效。
这些指标可以帮助医生和研究人员评估肿瘤治疗的效果,并为患者提供个性化的治疗建议。
一、nnU-Net自动分割经激光间质热疗(LITT)治疗的对比增强病变体积

文献概述
这篇文章是关于使用
深度卷积神经网络自动分割经激光间质热疗(LITT)治疗的脑内病变的研究。
LITT是一种治疗颅内肿瘤或放射坏死的方法,它允许组织诊断、细胞减量和快速恢复系统治疗。
治疗后,消融组织保留在原位,导致特征性的LITT后水肿,这与临床状况暂时恶化有关,并使LITT后反应评估复杂化。
研究方法包括:
- 训练一个基于
nnU-Net的自动分割模型,用于在T1加权图像上自动分割LITT治疗病变的对比增强病变体积(CeLV)。 - 对2015至2023年间在单一中心接受LITT治疗的肿瘤或放射坏死患者进行
回顾性研究,这些患者至少有9个月的MRI随访。
研究结果显示:
- 分析了
61个LITT治疗病变的384个独特的MRI检查和6个医学管理的放射坏死对照病例。 - 自动分割在367/384(95.6%)的图像中准确。
- CeLV在LITT后1至3个月增加到中位数68.3%(四分位间距35.1-109.2%),之后恢复到基线。
- LITT治疗患者的
总生存期(OS)为39.1(9.2-93.4)个月。 体积进展定义为从体积最低点或基线增加超过40%,56名患者中有21名(37.5%)经历了进展,体积进展无生存期为21.4(6.0-93.4)个月。- 有体积进展的患者OS较差(17.3个月对比62.1个月,P=0.0015)。
研究结论:
- LITT后的CeLV扩张是可量化的,并在LITT后6个月内解决。
- 为LITT治疗病变开发反应评估标准是可行的,并且应该被考虑用于临床试验。
- 自动病变分割可以加速在临床实践中采用体积反应标准。
研究的重要性在于,LITT作为神经肿瘤学中一个重要的治疗选择,目前尚无标准化的反应评估标准。
本文通过训练深度卷积神经网络来分割多种LITT治疗病变类型,使用对比增强体积的测量来描述消融病变的典型过程,并证明这些体积测量可以作为确定疾病进展的基础,应用一组可以在临床试验中使用的标准化反应评估标准。
重点关注
深度学习算法在自动分割过程中由于不同原因导致的分割不准确的例子。
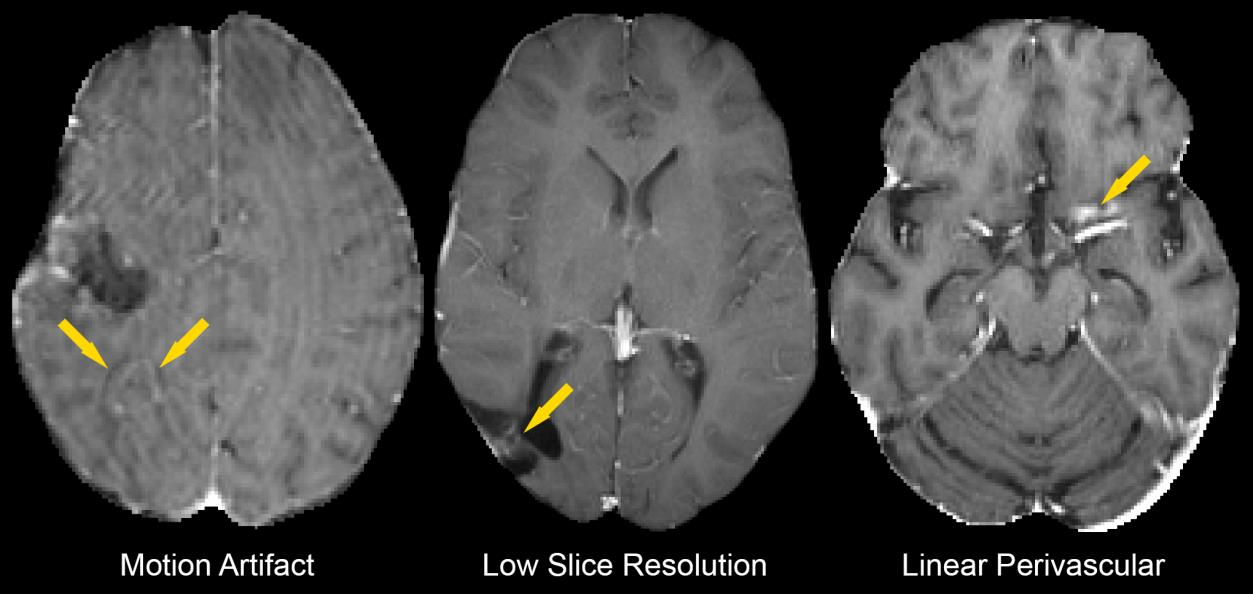
这些例子包括了对比增强的T1加权磁共振成像(MRI)图片,它们分别展示了由于以下原因造成的分割错误:
-
运动伪影(Motion Artifact):左侧的图片显示了由于患者在成像过程中移动导致成像模糊,这使得深度学习算法难以准确识别和分割病变区域。
-
层厚分辨率低(Low Slice Resolution):中间的图片指出了层厚分辨率不足的问题,即图像的层间距过大(例如≥5毫米),这导致病变的细节信息丢失,使得算法难以精确地识别病变的边界。
-
线性血管周围增强(Linear Perivascular Enhancement):右侧的图片展示了血管周围线性增强的情况,这被错误地识别为病变的一部分,导致分割结果不准确。
这些例子说明了自动分割算法在实际应用中遇到的挑战,尤其是在面对图像质量问题时。
研究中提到,在384次扫描中,有17次(4.4%)的分割被认为是潜在不准确的,其中这些情况占据了一部分。
这表明尽管深度学习算法在大多数情况下可以提供准确的分割,但在特定情况下仍需要人工审核或进一步的技术改进来提高分割的准确性。
二、AI揭示【体成分】与接受免疫治疗的晚期/转移性NSCLC患者的肿瘤学结果之间的关联

文献概述
这篇文章是一项关于接受
免疫治疗的晚期非小细胞肺癌(NSCLC)患者的体成分(BC)与肿瘤学结果之间关系的多队列分析研究。
研究的目的是评估体成分与接受免疫治疗的晚期或转移性NSCLC患者的肿瘤学结果之间的关联。
使用深度神经网络自动选择L3层并进行体腔分割(骨骼肌[SM]、皮下脂肪组织[SAT]和内脏脂肪组织),比较基于基线BC测量或在第一次随访扫描时的变化的结果。数据分析时间为2022年7月至2023年4月。
研究结果显示,骨骼肌质量的减少(通过L3 SM区域的变化指示)与跨患者组的更差肿瘤学结果相关。这种关联在男性患者中最显著,在MYSTIC试验和DFBCC-CIO队列的女性患者中无显著关联。
此外,皮下脂肪组织密度的增加(通过皮下脂肪组织间隔的平均CT衰减量化)与3个患者组的较差总生存期(OS)相关。这种变化主要在女性患者中观察到。
研究的结论
多队列研究表明,在NSCLC的系统治疗期间骨骼肌质量的减少是一个不良结果的标志,特别是在男性患者中。
皮下脂肪组织密度的变化也与预后相关,特别是在接受免疫检查点抑制剂治疗的女性患者中。自动化的CT衍生的BC测量应考虑在确定NSCLC预后时。
文章还讨论了体成分作为各种癌症潜在预后标志物的研究背景,以及在早期NSCLC治疗中基于影像的BC测量的效用。
此外,文章还提到了研究的限制,包括回顾性设计、患者群体的异质性以及深度学习管道的样本量小等问题,并指出需要进一步的研究来阐明这些关联背后的机制。
重点关注
在这项研究中,模型的工作流程和研究人群的构成如下:
A. 模型实施的工作流程:
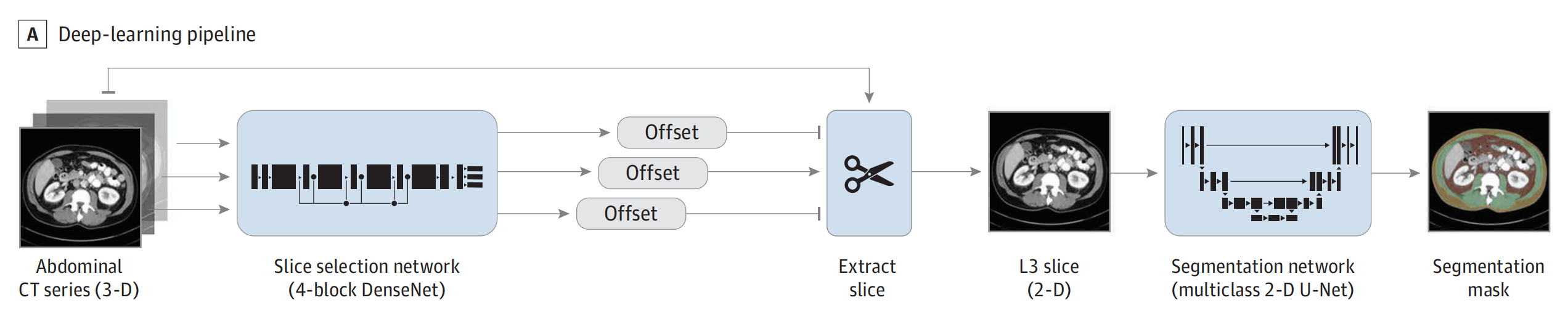
- 实验中实施了一个深度学习管道,用于自动处理和分析体成分数据。
- 这个管道包括两个深度学习模型,它们在隔离的容器中运行,使用Python 3.7.3、Ubuntu 18.04操作系统、CUDA 10.0和cuDNN 7.4.2环境。
- 模型的开发和实施发生在2020年至2023年之间,并且模型和相关代码在GitHub上公开可用,也集成到了开源的modelhub.ai平台。
B. 研究人群:
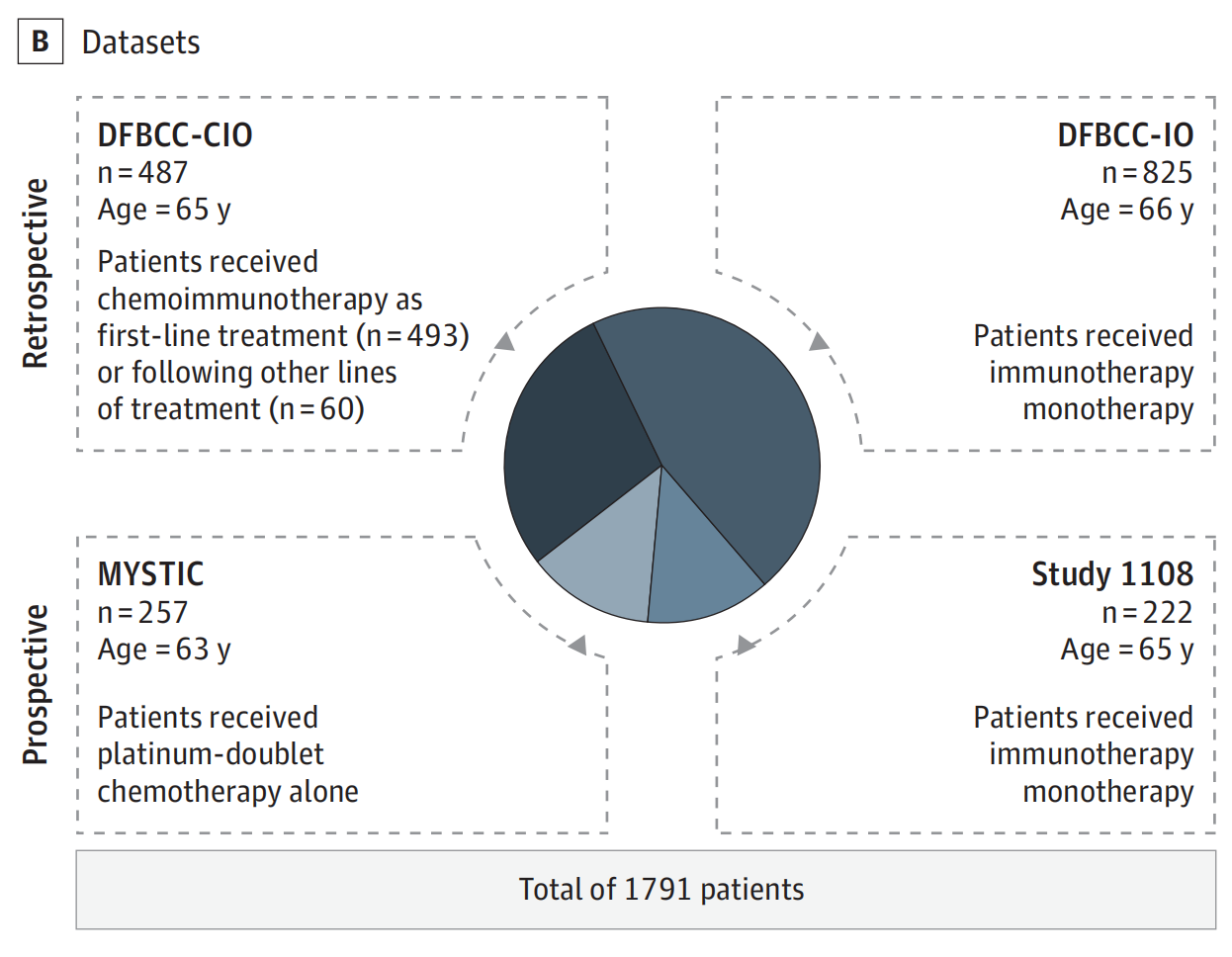
- 研究人群包括来自Dana-Farber Brigham癌症中心(DFBCC)的两个回顾性队列,分别是接受
化疗免疫疗法(CIO)和免疫检查点抑制剂单药治疗(IO)的患者。 - 还包括来自1108研究和MYSTIC试验的前瞻性收集的临床试验数据。
C. 体成分分析:
- 在基线和随访扫描时对体成分进行了分析。
- 使用自动化的深度学习管道从CT图像中提取体成分测量数据,包括骨骼肌(SM)、皮下脂肪组织(SAT)和内脏脂肪组织(VAT)。
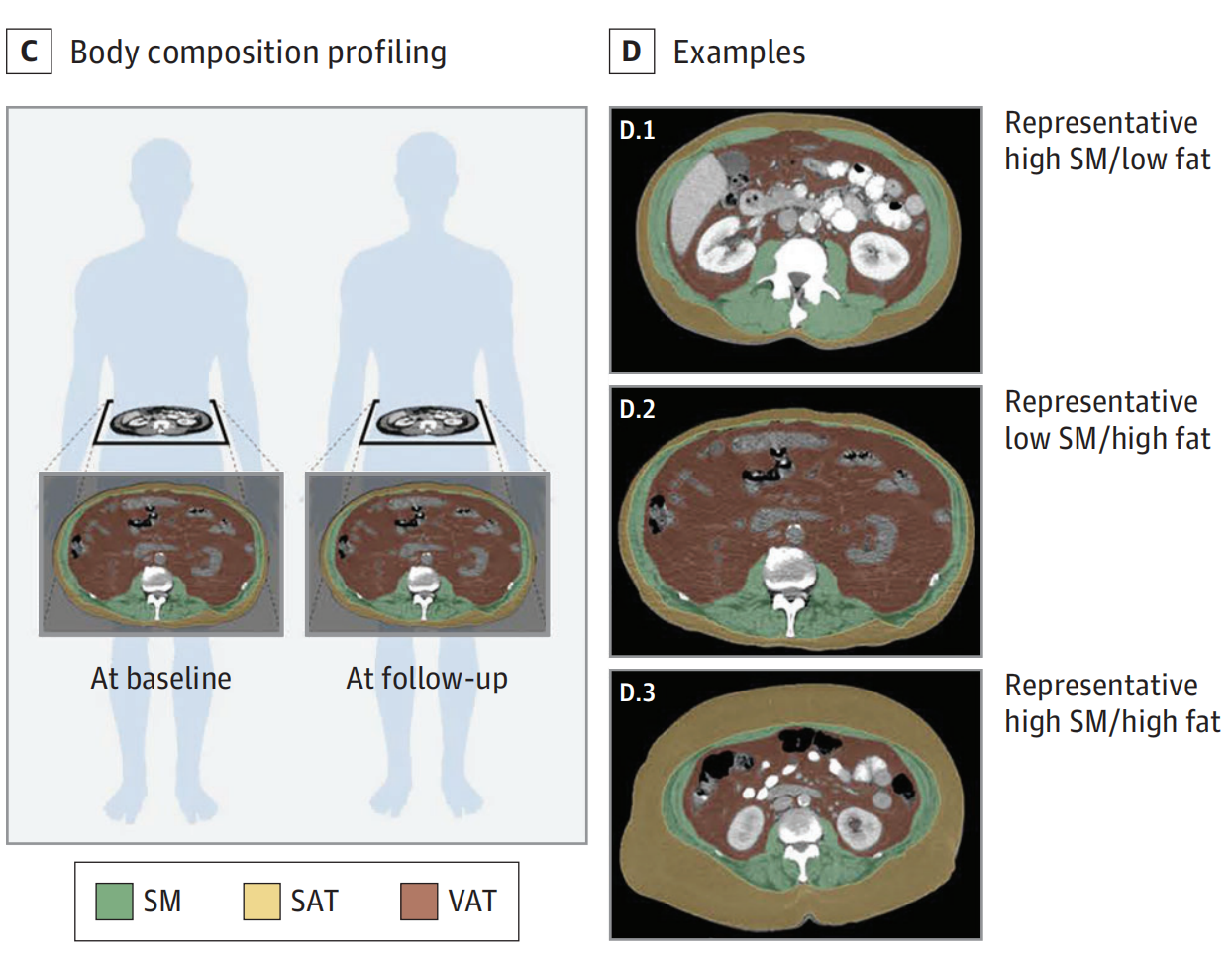
D. 模型输出示例:
- 模型的输出展示了不同体成分分布的代表性图像。
- 黄色代表皮下
脂肪组织(SAT)。 - 绿色代表
骨骼肌(SM)。 - 棕色代表
内脏脂肪组织(VAT)。
- 黄色代表皮下
- 展示了三种不同的体成分分布情况:
- 高SM/低脂肪分布。
- 低SM/高脂肪分布。
- 高SM/高脂肪分布。
- D.2和D.3面板还分别描绘了具有高VAT和高SAT的个体,从而展示了这两种不同的体成分表型。
2-D和3-D的说明:
- 2-D表示二维,指的是在单个CT图像层面上的分析。
- 3-D表示三维,涉及到整个体成分分析的三维重建或评估。
CT的说明:
- CT指的是计算机断层扫描,这是一种医学成像技术,用于获取患者身体内部结构的详细图像,以便于进行体成分分析。
总体而言,这项研究使用了先进的深度学习技术来自动化地从CT图像中分析和量化晚期非小细胞肺癌患者的体成分,以评估其与肿瘤学结果之间的关联。
三、AI赋能基于扩散和灌注的MRI,提高对胶质母细胞瘤患者生存率的预测准确性

文献概述
这篇文章标题为“Cluster-based prognostication in glioblastoma: Unveiling heterogeneity based on diffusion and perfusion similarities”,由Martha Foltyn-Dumitru等人撰写,发表在《Neuro-Oncology》杂志上。
研究的主要目的是开发基于扩散和灌注MRI的预后模型,以提高对胶质母细胞瘤(glioblastoma,GB)患者生存率的预测准确性。
研究包括了289名接受了术前多模态MRI成像的胶质母细胞瘤患者。
研究者计算了不同肿瘤区域和整个肿瘤的表观扩散系数(ADC)、相对脑血容量(nrCBV)和相对脑血流量(rCBF)的平均值。
通过使用基于中心对象的聚类(Partition Around Medoids, PAM)方法,研究者在训练数据集上识别出了两种具有显著不同总生存期(OS)的稳定成像表型。
在独立测试数据集上的验证显示,高风险组的中位OS为10.2个月,而低风险组的中位OS为26.6个月。
研究表明,数据驱动的聚类能够识别出具有临床相关性的不同成像表型,突出了扩散和灌注MRI在预测胶质母细胞瘤患者生存率方面的潜在作用。研究还发现,将聚类成员资格纳入所有多变量Cox回归分析中可以提高性能。
研究强调了通过无监督数据驱动方法来解决当前对胶质母细胞瘤的理解和治疗中的重要需求,研究结果有助于指导临床决策,改善预后模型,并最终为胶质母细胞瘤患者带来更好的管理和治疗结果。
重点关注
研究的流程和步骤
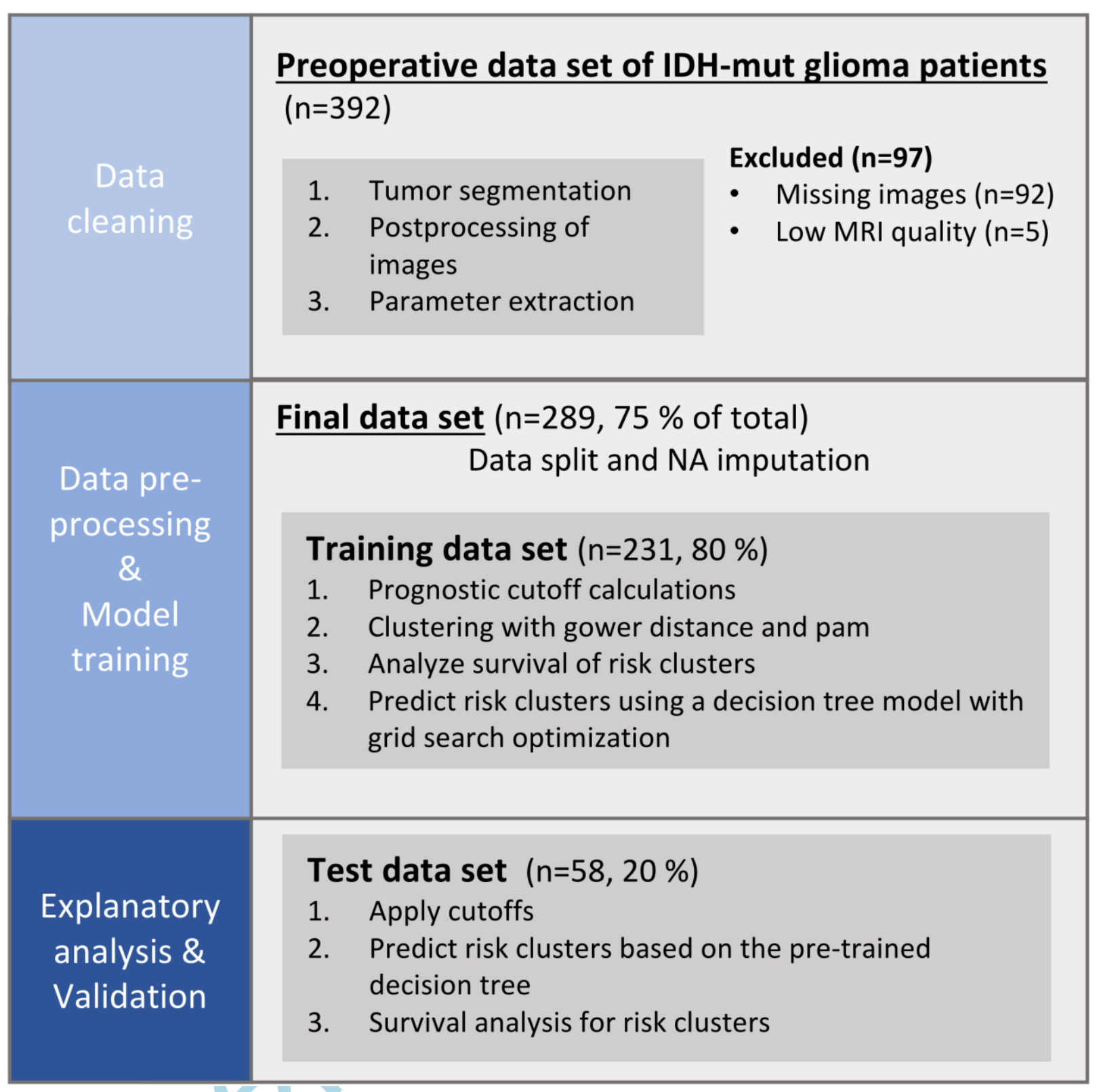
-
数据集划分:研究开始于将数据集分为两个主要部分:训练集和测试集。训练集用于进行主要的数据分析和模型训练,而测试集则被保留用于对最终模型进行无偏评估。
-
计算阈值(Cutoffs Calculation):在训练集上,研究者计算了用于聚类分析的阈值。这些阈值与成像参数(如ADC、nrCBV和rCBF)的特定临界点有关,用于区分不同的成像表型。
-
聚类(Clustering):使用训练集数据,研究者应用了聚类算法,特别是PAM聚类,来识别数据中的自然分组或“表型”。这些表型基于扩散和灌注成像的相似性。
-
模型训练(Model Training):在确定了聚类后,研究者使用训练集数据来训练预测模型。这包括机器学习算法,用于预测患者的总生存期。
-
模型评估(Model Evaluation):测试集在模型训练完成后使用,作为一个独立的数据集来评估模型的性能。这确保了模型的泛化能力,即在未见过的数据上的表现。
-
无偏评估(Unbiased Evaluation):使用测试集进行的评估旨在提供一个没有偏见的模型性能度量。这意味着测试集数据在模型训练过程中没有被使用,从而避免了过拟合的风险。
整体而言,Figure 1 强调了研究方法的严谨性,通过分离数据集来确保研究结果的可靠性和模型的预测能力。
四、AI辅助阅片系统,提升乳腺癌早筛的准确性

文献概述
研究探讨了人工智能(AI)辅助的筛查阅读技术在提高
乳腺癌早期检测中的潜在应用。
研究团队通过前瞻性地在三个阶段实施了AI系统:单中心试点、多中心试点和全面实施,以评估AI作为额外阅读者在标准双重阅读过程中的性能。
研究发现,与双重阅读相比,AI辅助的额外阅读过程能够在每1000个案例中额外检测到0.7至1.6个癌症案例,同时只增加0.16%至0.30%的额外召回,0%至0.23%的不必要召回,并且在7%至11%的AI标记案例中增加0.1%至1.9%的阳性预测值(PPV),这相当于增加了4%至6%的总体阅读工作量。
**AI辅助检测的大多数癌症案例为侵袭性(83.3%)且体积较小(≤10 mm,47.0%)。**研究表明,AI作为额外阅读者可以提高乳腺癌的早期检测率,并且几乎不增加不必要的召回。
文章还讨论了将AI集成到临床工作流程中的挑战,包括确保患者安全、持续性能监测以及与现有临床流程的整合。
研究结果表明,AI系统可以有效地部署,并在实际临床工作流程中实现其预测的益处。
研究的局限性包括数据仅来自一个国家的单一乳腺癌筛查机构,且只评估了一个商业AI系统,因此结果不具有普遍性。
尽管如此,这项研究提供了使用AI进行乳腺癌筛查的证据,并展示了其安全部署的具体步骤。
重点关注
AI作为辅助阅读者的工作流程
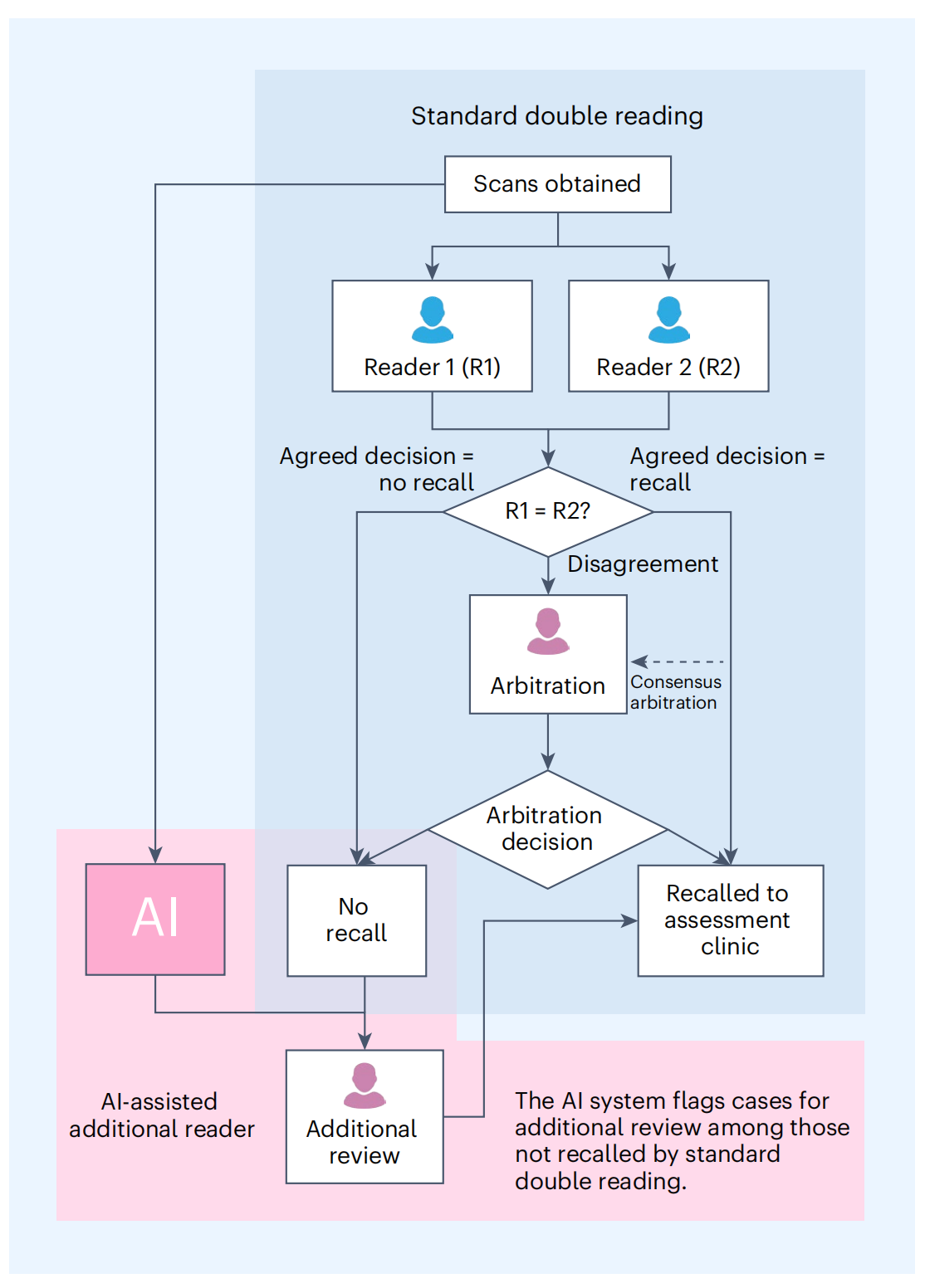
在这个流程中,首先使用标准的双重阅读过程来评估乳房X线照片。
双重阅读意味着每张乳房X线照片都由两位放射科医师独立评估。如果两位医师在评估后达成一致,认为不需要召回(即没有发现可疑的异常情况),那么这个案例就会被认为是“不召回”。
然而,如果AI系统在双重阅读结果为“不召回”的情况下标记了这个案例,表明AI在图像中发现了的异常,这时就会启动额外的步骤。
AI系统会标记出图像中它认为表明恶性肿瘤的区域。然后,这个案例将由另一位经过专业培训的人类仲裁者(额外的仲裁者)进行独立评估。这位仲裁者会根据AI系统提供的感兴趣区域(regions of interest)来审查图像,并做出最终的召回决定。
这个流程的目的是利用AI的高敏感性来识别被人类阅读者遗漏的癌症案例,从而提高早期检测乳腺癌的准确性。通过这种方式,AI辅助的额外阅读者工作流程可以作为一个质量控制的安全网,支持早期癌症的检测。
五、基于MRI的放射组学特征在局部复发鼻咽癌患者预后中的潜力

文献概述
这篇文章我之前仔细分析过,因为就是我们课题组发的文章,感兴趣的可以去看精析。
基于MRI的放射组学特征在局部复发鼻咽癌患者预后中的潜力
研究的主要目的是开发一种基于磁共振成像(MRI)的放射组学特征特征,以揭示肿瘤免疫异质性,并预测局部复发鼻咽癌(lrNPC)患者的生存情况。
研究包括921名lrNPC患者,使用机器学习技术基于预处理MRI特征开发了一种用于预测总生存期(OS)的特征,并在两个独立队列中进行了验证。
研究结果
机器学习特征和列线图与传统的临床列线图相比具有可比的预后能力,在训练队列、内部和外部验证队列中分别达到了0.729、0.718和0.731的一致性指数(C-index)。
将特征与临床变量结合可以显著提高预测性能。该特征有效地区分了风险组患者,这些患者具有明显不同的OS率。
通过RNA测序(RNA-seq)分析,探索了特征的生物学特性和免疫浸润,发现风险组之间在干扰素反应和淋巴细胞浸润方面存在差异。
研究结论
基于MRI的放射组学特征能更准确地预测OS。提出的与肿瘤免疫异质性相关的特征是一个有价值的工具,有助于促进lrNPC患者的预后分层和指导个体化管理。
关键词包括局部复发鼻咽癌、MRI、放射组学、生存分析。研究由多个中国机构资助,包括国家重点研发计划、国家自然科学基金等。作者声明没有利益冲突,且资助方在研究设计、数据收集、分析、发表决定或手稿准备中没有作用。
重点关注
放射组学工作流程和生物信息学工作流程

放射组学工作流程(Radiomics workflow):
- 图像获取:在四个中国的医疗中心,共识别了921名合格的局部复发鼻咽癌(lrNPC)患者,并且所有患者都接受了预处理的头部和颈部磁共振成像(MRI)。
- 手动分割:在获取图像后进行手动分割,以确定肿瘤的感兴趣区域(ROI)。
- 特征提取与放射组学特征构建:基于分割的图像,提取放射组学特征,并构建放射组学特征。
- 预后模型的开发与验证:利用这些特征开发预后模型,并通过内部和外部队列进行验证。
- 模型性能评估:评估所开发模型的性能。
生物信息学工作流程(Bioinformatics workflow):
- 组织样本收集:从研究队列中收集了21个组织样本。
- RNA测序:这些组织样本进行了RNA测序(RNA-seq)。
- 生物信息学分析:使用生物信息学工具分析RNA-seq数据,探索不同放射组学特征背后的生物学特性和免疫浸润情况,以反映lrNPC内部的肿瘤异质性。
在文中还提到了一些特定的术语和缩写,例如:
- CET1-w:对比增强的T1加权成像。
- CHCAMS:中国医学科学院肿瘤医院。
- FUSCC:复旦大学上海癌症中心。
- LrNPC:局部复发鼻咽癌。
- MRI:磁共振成像。
- NHSMU:南方医科大学南方医院。
- SYSUCC:中山大学肿瘤中心。
- T1-w:T1加权成像。
- T2-w:T2加权成像。
整个研究布局强调了多中心合作、综合利用放射组学和生物信息学方法来提高对局部复发鼻咽癌预后的理解和预测。
六、基于回归的深度学习方法,从病理切片中预测分子生物标志物

文献概述
这篇文章讨论了一种基于回归的深度学习方法,用于从病理切片中预测分子生物标志物。
研究团队开发并评估了一种自监督的、基于注意力机制的弱监督回归方法,该方法能够直接从11,671张覆盖九种癌症类型的患者图像中预测连续的生物标志物。
研究发现,使用回归方法可以显著提高生物标志物预测的准确性,并且与分类方法相比,能够更好地对应于已知的临床相关区域。
在结直肠癌患者的大型队列中,基于回归的预测分数比基于分类的分数提供了更高的预后价值。此外,该研究还探讨了如何通过数字病理学分析组织样本来提供有关肿瘤分级、亚型、分期和其他肿瘤生物标志物的信息。
研究结果表明,回归方法在计算病理学中为连续生物标志物分析提供了一个有希望的替代方案。
文章还提到了数字病理学的发展,以及如何利用深度学习技术从全切片图像(WSI)中预测基因变化和基因表达模式。
研究团队通过对比增强的聚类注意力多实例学习(CAMIL)回归方法与传统的分类方法进行了系统比较,发现CAMIL回归方法在多个数据集、器官和生物标志物上的表现优于传统方法。
此外,文章还讨论了回归方法在预测肿瘤微环境中的关键生物过程标志物方面的优势,包括肿瘤细胞、基质和免疫细胞的相关生物标志物。
研究结果表明,CAMIL回归方法能够以高AUROC值预测这些生物标志物,并且在与CAMIL分类方法和Graziani等人提出的回归方法相比时,表现出更好的性能。
最后,文章还探讨了CAMIL回归方法在预测结直肠癌患者总体生存方面的应用,并发现基于回归的生物标志物能够提供更好的预后预测。
研究团队认为,他们的开源回归方法为病理学中的连续生物标志物分析提供了一个有希望的替代方案,并对精准医疗产生重要影响。
重点关注
端到端实验工作流程的概览——图像预处理、建模、性能指标评估以及所使用的队列。
以下是详细分析:
A. 图像预处理流程和瓦片级特征提取:
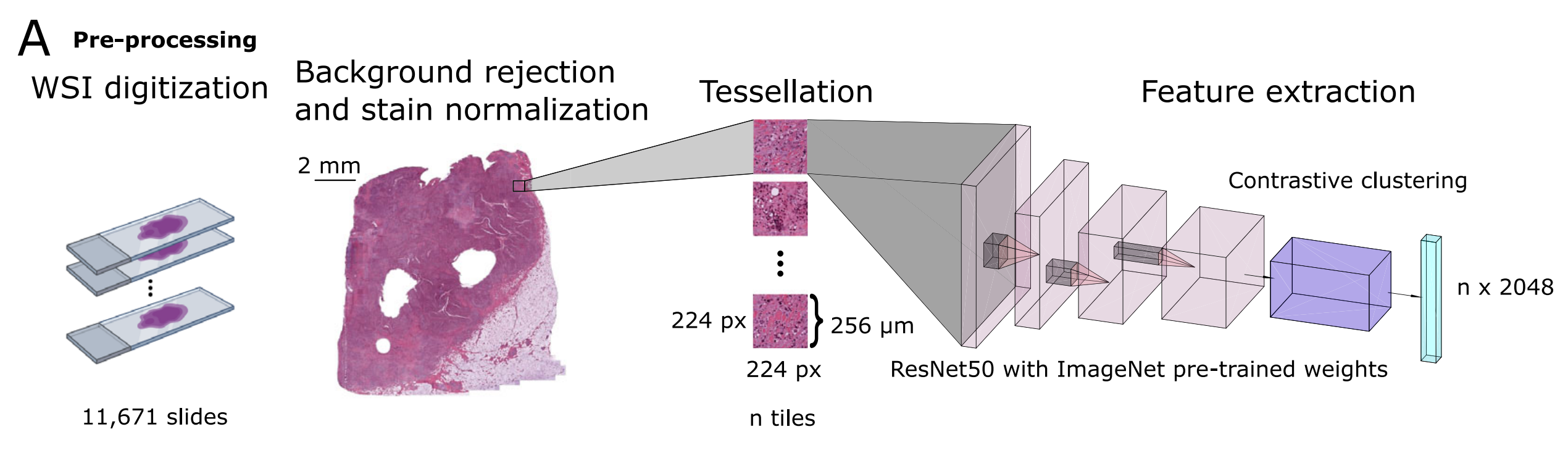
- 使用带有预训练的ImageNet权重的
ResNet50模型进行推理,以及检索对比聚类(RetCCL)模型,为每个患者生成特征矩阵。 - 这一步骤涉及将全切片图像(WSI)分割成小块(tiles),并对这些小块进行处理,以提取可用于后续分析的特征。
B. 建模架构:
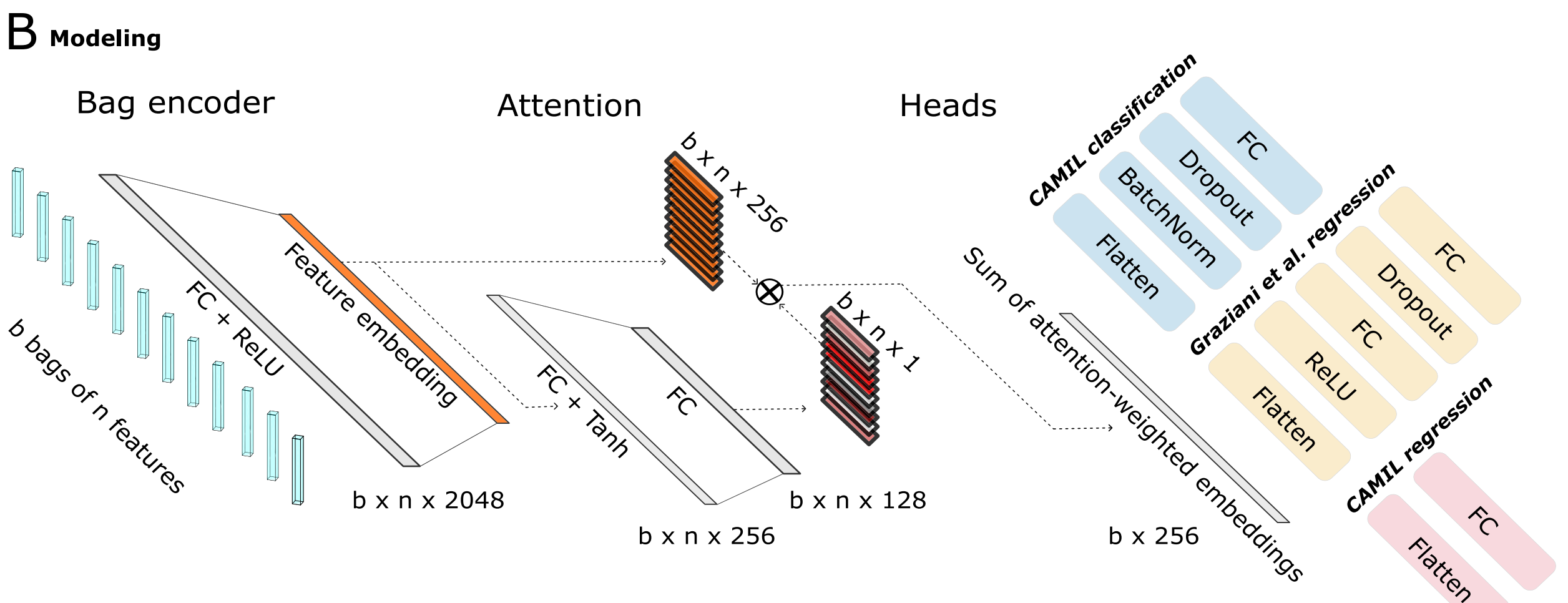
- 利用基于注意力的
多实例学习(attMIL)应用在自监督提取的特征上。 - 该架构包含三个独立训练的头(heads):
- 一个用于CAMIL分类。
- 一个用于回归,遵循Graziani等人提出的方法。
- 第三个用于本研究介绍的CAMIL回归方法。
C. 性能指标及其置信区间(CIs):
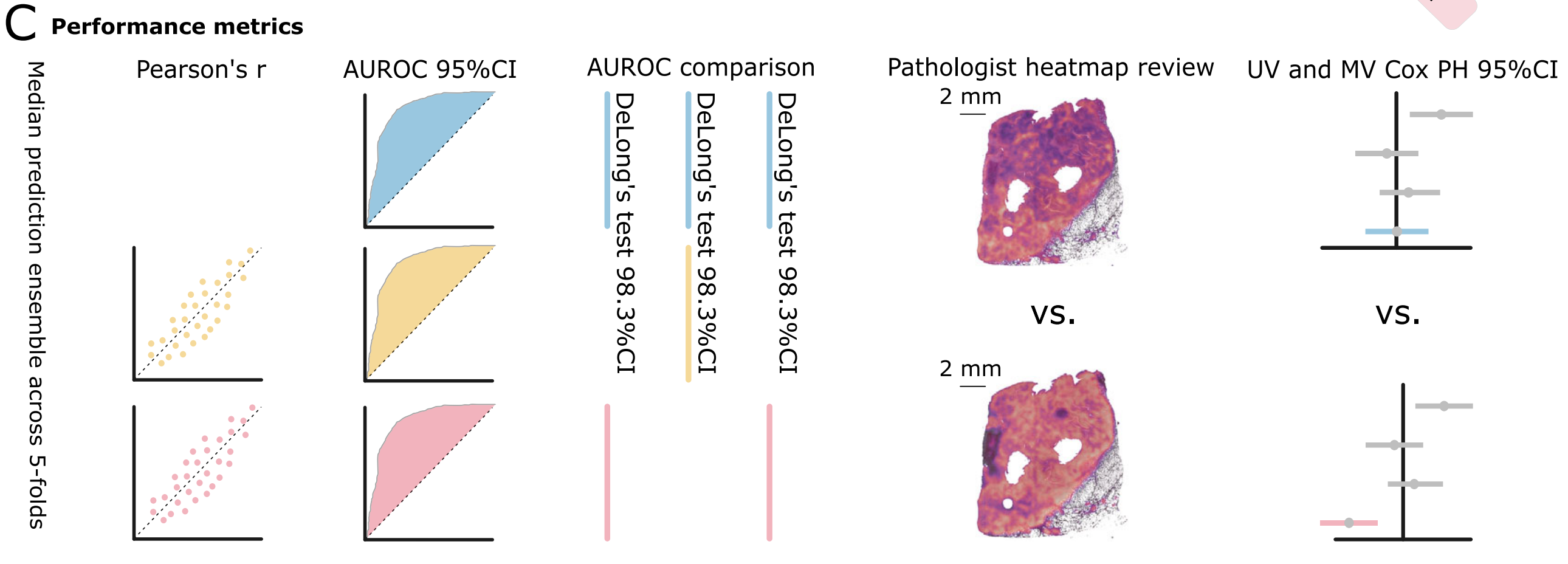
- 评估模型的三个独立训练头的性能指标包括:
- 回归模型使用皮尔逊相关系数(Pearson’s r)。
- 所有模型使用接收者操作特征曲线下面积(AUROC)。
- 对同源重组缺陷(HRD)和生物过程生物标志物进行了配对双尾DeLong测试。
- 进行了注意力热图的专家评审,以及对生物过程模型进行了单变量(UV)和多变量(MV)Cox比例风险(PH)模型分析。
D. 队列图表表示:
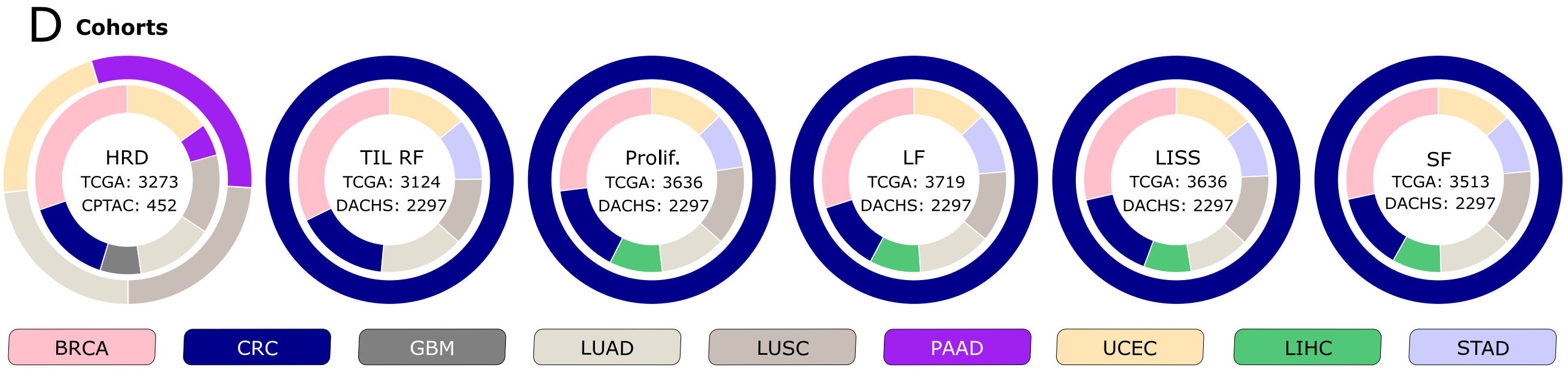
- 展示了本研究中使用的队列,内外圈分别表示用于训练和外部验证的队列。
- 训练队列来源于癌症基因组图谱(The Cancer Genome Atlas, TCGA)项目的所有临床目标。
- 外部验证队列来自临床蛋白质组肿瘤分析联盟(Clinical Proteomic Tumor Analysis Consortium, CPTAC)的努力,以及Darmkrebs: Chancen der Verhütung durch Screening (DACHS)研究,分别针对HRD目标和生物过程生物标志物。
- 考虑的
生物过程生物标志物包括肿瘤浸润淋巴细胞区域分数(TIL RF)、增殖(Prolif.)、白细胞分数(LF)、淋巴细胞浸润特征分数(LISS)和基质分数(SF)。 - 研究中考虑的
癌症类型包括乳腺癌(BRCA)、结直肠癌(CRC)、胶质母细胞瘤(GBM)、肺腺癌(LUAD)、肺鳞状细胞癌(LUSC)、胰腺腺癌(PAAD)、子宫内膜癌(UCEC)、肝细胞癌(LIHC)和胃癌(STAD)。
这个流程图提供了研究方法的清晰视觉表示,从图像预处理到模型评估,再到使用的队列,为读者呈现了研究的全貌。


![undetected_chromedriver驱动浏览器结束报错OSError: [WinError 6] 句柄无效](https://img-blog.csdnimg.cn/direct/d253e2b01ba248c99ef957cc8708285d.png)