目前临床上需要制定策略来更好地识别哪些患者可以从单独的免疫疗法中受益,或者哪些患者可能需要化疗或放疗等额外疗法来克服耐药性。尽管一些联合放射治疗(RT)和免疫检查点抑制(ICI)的临床研究取得了成功,但许多研究结果好坏参半,部分原因是我们对RT如何影响免疫反应的机制了解有限。近期Cancer cell杂志发表了一项题名“Single-cell and spatial profiling identify three response trajectories to pembrolizumab and radiation therapy in triple negative breast cancer”的研究。该研究对anti-PD-1治疗并额外接受RT治疗的 三阴乳腺癌(TNBC)患者进行了纵向活检,使用PCF空间单细胞蛋白组(原名CODEX)技术和scRNA-seq 进行了检测。该研究发现了TNBC 由包含独特的细胞表型组合的空间区室组成。重要的是,基于这些区域的纵向活检分析确定了应答患者和无应答患者不同的空间组成,同时应答组也存在两种不同的空间结构组成。

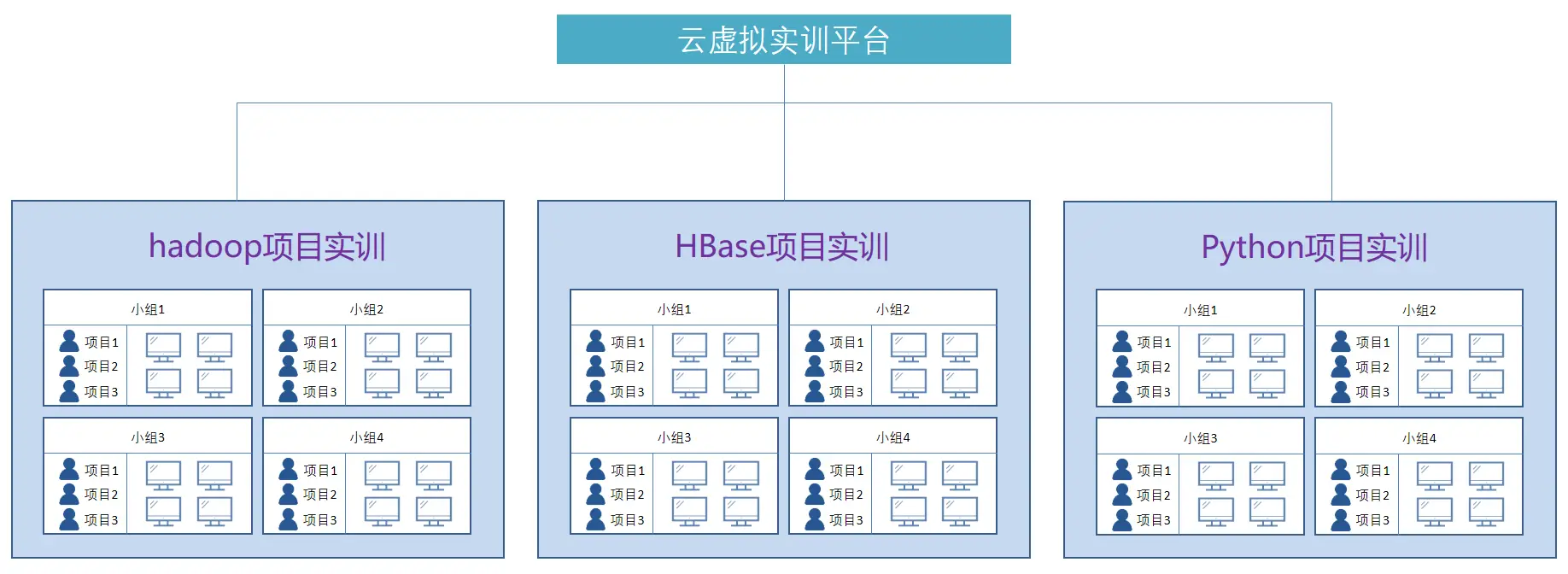
实验设计
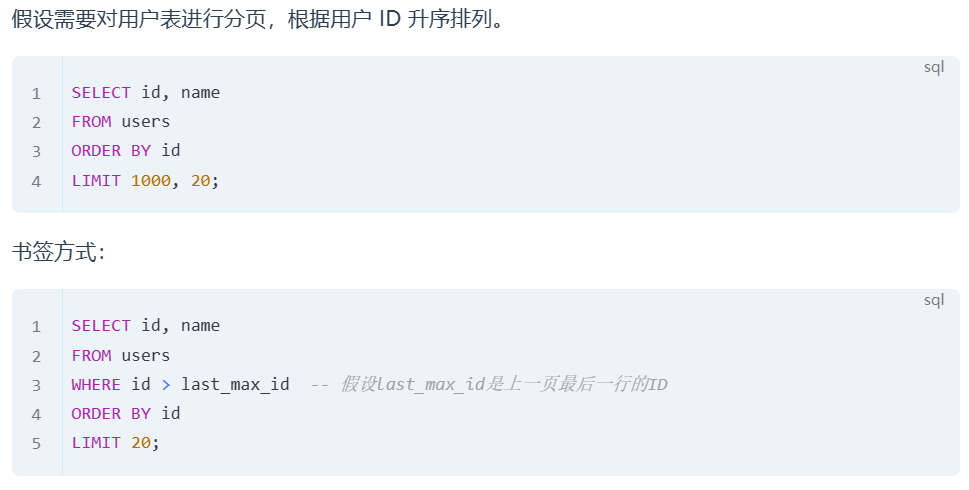
总共50名TNBC患者纳入临床试验中,分别在anti-PD-1治疗第1个周期之前、第1个周期后的第3周以及anti-PD-1治疗第2个周期和局部放疗后第3周,总共3个时间点进行活检。总共34名患者的活检可进行评估。活检部分用于scRNA-seq,部分用于PCF空间单细胞蛋白组检测。最终该研究分析了34名患者scRNA-seq检测的50多万个细胞表达谱,以及27名患者PCF空间单细胞蛋白组检测的5百多万个细胞的空间信息。
01 PCF空间单细胞蛋白组学
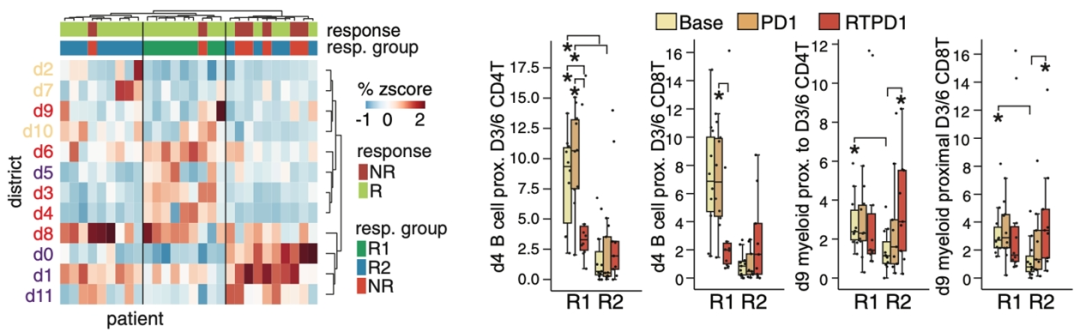
该研究通过检测18个蛋白marker,诠释了10多种不同的细胞类型。然后通过神经网络模型构建了12个空间区域(districts,d)。
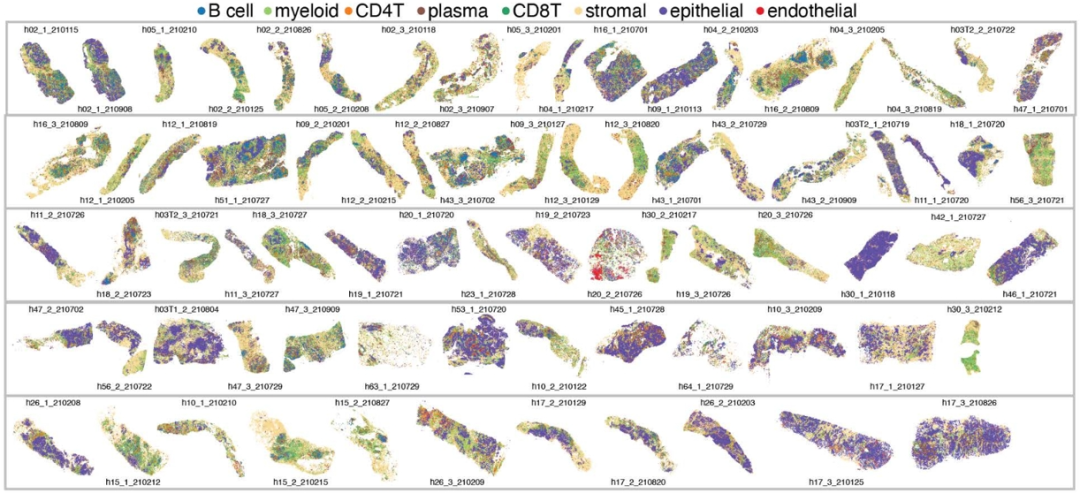
d0、d1、d5 和 d11区包含89%的上皮细胞。d2 和 d10主要包含基质细胞,d7是内皮细胞区。d9区主要是髓细胞 (78%) 和一些 CD4+ T细胞 (11%)。d6主要包含了CD20+ B细胞 (10%)、CD4+ T细胞(13%)、CD8+ T 细胞 (18%)、髓细胞 (19%) 和基质细胞 (37%)。大多数CD138+ 浆细胞 (95%) 位于 d8 区,与上皮细胞、髓细胞和基质细胞 (>10%) 共定位。d3和d4 区以淋巴细胞为主,其中d3含有最多的 CD4+ T 细胞(39%) 和 CD8+T 细胞(41%),而d4 含有最多的B细胞 (54%)。

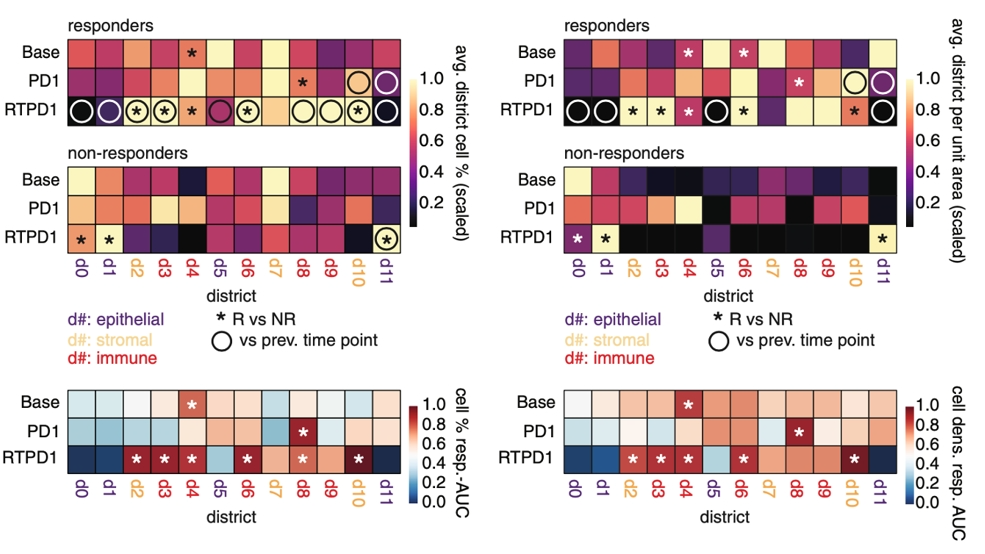
B细胞优势区d4是基线时响应者中唯一比例和密度较高的区域,同时时富含T细胞的d6 密度也更高。免疫区d3、d6、d8 和 d9仅在应答者联合治疗(RTPD1)后的样本中比例增加,其中d3和d6 的比例和密度都高于无应答者。相反,RTPD1 后响应者中的上皮区 d0、d1 和 d11消失,而无应答者中没有变化。AUROC分析发现了类似的趋势,治疗前,d4 是唯一与应答相关的区域 (AUROC > 0.75),但在 RTPD1 后,所有免疫丰富区域(d3、d4、d6、d8 和 d9)在应答者中的比例和密度均较高。这些结果说明了治疗重塑了TNBC的免疫微环境。
02 响应患者具有两种不同的空间亚型
无监督聚类分析活检的空间区域可以将肿瘤组织分为3 组,其中大多数无应答者形成一个亚组NR,而响应患者形成两个亚组: R1和 R2。应答组表现出不同的免疫轨迹,其中 R1 开始时免疫细胞密度较高,但每次治疗后免疫细胞密度有所下降,而 R2 仅在 RTPD1 后看到免疫细胞密度增加。空间关系上,在基线期和单独免疫治疗后,R1中T 细胞区域d3/d6附近具有更多的B细胞区域d4,但这种差异在 RTPD1 后消失。同样的,在基线期, R1 中T细胞邻近 d9 髓细胞区域,但这种差异也在 RTPD1 后也消失。
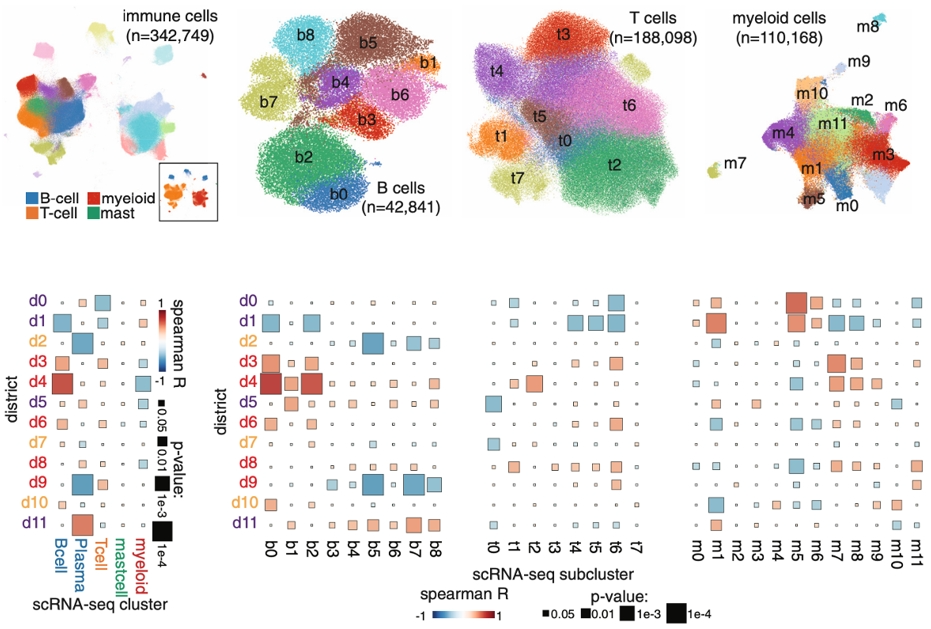
03 整合PCF空间单细胞蛋白组和scRNA-seq
研究者分析了配对的CD45+ 细胞scRNA-seq 数据。scRNA-seq鉴定了B细胞/浆细胞、T 细胞、髓细胞和肥大细胞。并且通过差异基因表达分析 (DGEA) 和 CellTypist对 B细胞/浆细胞、T 细胞和髓细胞进行了亚群分析。相关性分析发现了PCF空间区域和 scRNA-seq 细胞亚群之间存在一致性。d4主要由 B 细胞组成,其丰度与 scRNA-seq 数据集中 B细胞的丰度相关性最强。同样,scRNA-seq 中T细胞丰度与 T 细胞富集区 d3、d6 和 d9 相关。在细胞亚群水平上,CD20+ sc-b0、sc-b2 亚群与 d4 的关联性最高。效应 T 细胞亚群 sc-t4 和 sc-t6 与 T 细胞区 d3、d6、d8 和 d9 表现出更强的相关性。值得注意的是, d8和 d9 与效应T细胞相关,也与抗原呈递巨噬细胞亚群 (sc-m11) 相关。研究者后续着重分析了效应T细胞扩增在空间上与抗原呈递巨噬细胞的富集具有显著相关性。对比分析发现了只有在R2响应组中,空间上d6/d9 共密度和 sc-t6 效应T细胞扩增具有显著相关性。
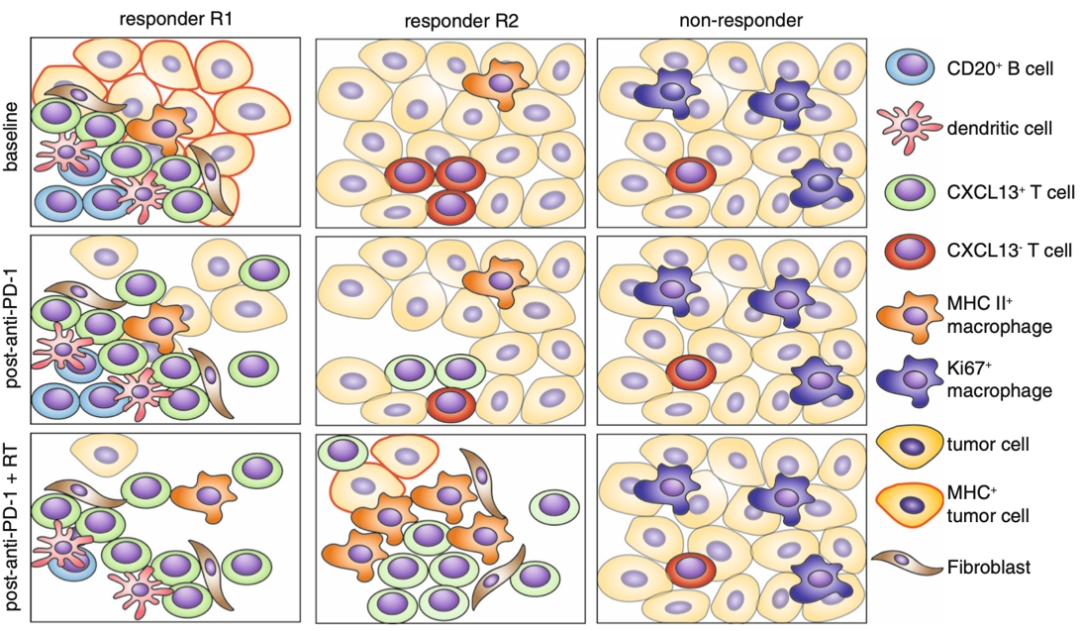
总结与讨论
最终这项研究联合空间原位分析和单细胞测序,将TNBC患者对免疫治疗/放射治疗反应进行了分类。无应答者在治疗前后缺乏免疫浸润,并且表现出最小的治疗诱导的免疫变化。响应患者分为两组,在治疗前可通过分类器进行区分,其中一组在治疗前表现出高的MHC表达、存在三级淋巴结构,并表现出抗肿瘤免疫效能。另一组应答者在基线时与无应答者相似,只有在联合治疗后才会产生最大的免疫应答,其特征是细胞毒性 T 细胞和抗原呈递髓细胞相互作用。并且这些空间互作关系也在小鼠模型上得到了验证。
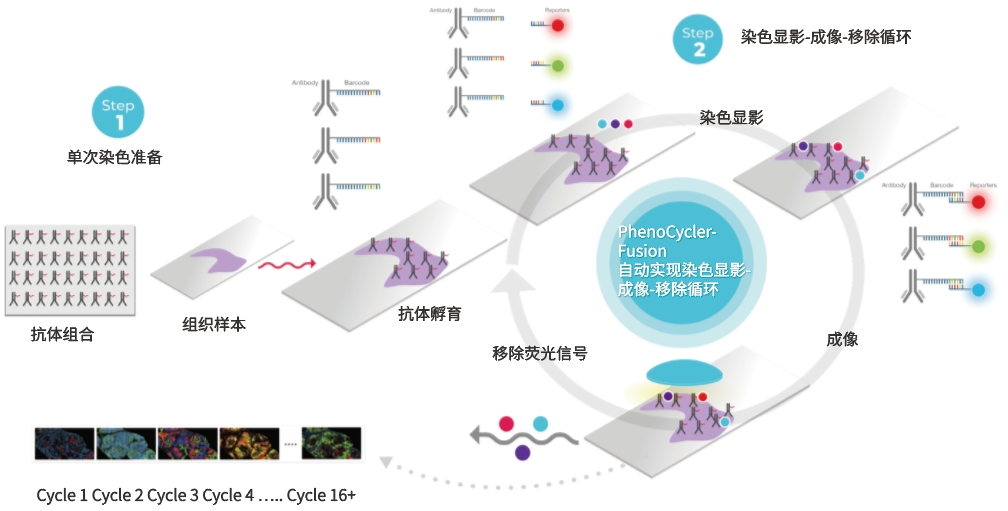
| PCF空间单细胞蛋白组学介绍
PCF采用oligo偶联抗体检测技术结合自动化高分辨荧光显微镜,可实现超多靶标的空间定位及单细胞分辨率下的细胞表型分析。所有抗体先一次性与组织切片结合,再启动抗体和荧光探针的“杂交 — 成像 — 剥离”三步循环,每次循环后通过荧光显微镜收集检测抗体的荧光信号。
| PCF单细胞原位空间蛋白组学优势
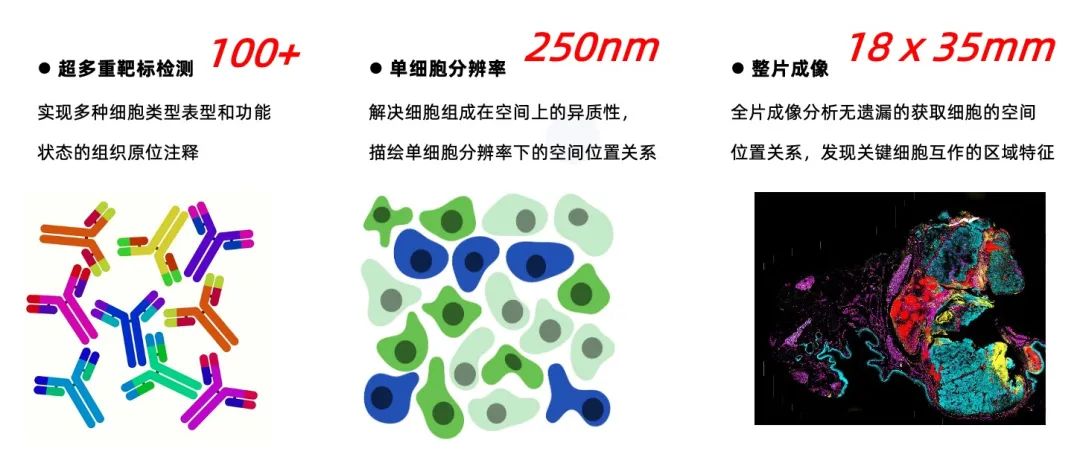
华盈生物PhenoCycler-Fusion单细胞原位空间蛋白组学技术
华盈生物是美国Akoya Bioscience公司的PhenoCycler-Fusion空间单细胞蛋白组学技术认证服务商,已经被纳入了该技术的全球CRO服务提供者体系。借助全球领先的PhenoCycler-Fusion空间单细胞蛋白组学技术平台的建立,华盈生物将为中国客户提供更具精准医学特色的服务与合作,推动中国团队在空间生物学领域的研究水平,加快构建符合中国人群的精准医学模式。

即刻加入“STAMP邮戳”计划
华盈生物推出肿瘤微环境空间蛋白组解剖分析项目”STAMP邮戳”计划(Spatial Tumor Anatomy of Microenvironment Proteome),常备15-plex、25-plex、35-plex三款固定标志物组合,与国内肿瘤研究领域的科学家共同推进肿瘤空间生物学研究。
业务咨询400-869-2936或17316301592(微信同号)
相关文献
Shiao SL, Gouin KH 3rd, Ing N, Ho A, Basho R et al. Single-cell and spatial profiling identify three response trajectories to pembrolizumab and radiation therapy in triple negative breast cancer. Cancer Cell. 2024;42(1):70-84.e8.
![]()
1)“空间单细胞蛋白组高级研修班”第2期开班报名通知
2)PCF空间单细胞蛋白组发现免疫治疗反应关键的肿瘤微环境区域
3)Nature:PCF空间单细胞蛋白组构建肠道组织结构图谱
4)组织原位空间标志物:“PCF空单蛋“建立预测免疫治疗响应的新型空间评分系统
5)Cell:空间单细胞蛋白组学揭秘肝细胞癌中的细胞互作机制
| 工作邮箱:market@wayenbiotech.com


![[Linux+git+Gitee+Jenkins]持续集成实验安装配置详细](https://i-blog.csdnimg.cn/direct/c042769fa24142b8b5dcebedba50c910.png)