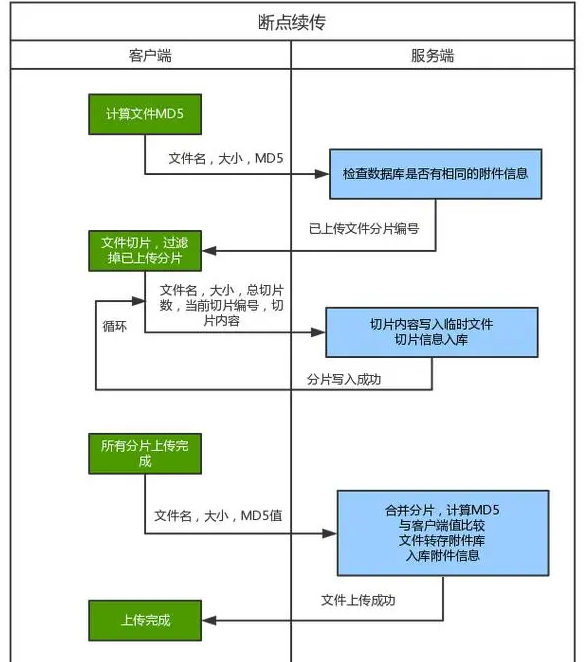
医疗器械在欧美上市时,需要提交的网络安全相关申报文件主要包括以下几个方面,这些要求基于欧美地区的法律法规和监管机构的指导文件。
一、美国FDA要求
1. 网络安全管理计划
内容:制造商需要提交一份网络安全管理计划,该计划应包含在合理的时间内监控、识别并酌情解决上市后的网络安全漏洞和利用的策略,包括协调一致的漏洞披露和相关程序。
依据:根据FD&C法案第524B(b)(1)条,这是FDA对医疗设备网络安全的基本要求之一。
2. 设计、开发和维护流程与程序
内容:制造商必须设计、开发和维护流程与程序,以提供合理的网络安全保证。这包括设备及相关系统的网络安全防护措施。
依据:FD&C法案第524B(b)(2)条对此有明确规定。
3. 软件物料清单(SBOM)
内容:制造商需要提交包含商业、开源和现有软件组件的SBOM,以便FDA评估设备的网络安全状况。
依据:FD&C法案第524B(b)(3)条要求提供SBOM。
4. 上市前提交的其他材料
内容:根据FDA的《医疗器械的网络安全指南:质量体系需考虑的因素和上市前需提交的材料》,制造商还需要提交其他与网络安全相关的文件,如网络安全风险评估报告、漏洞修复计划等。
依据:FDA发布的指南文件。
二、欧洲MDR要求
1. 网络安全风险评估
内容:制造商需要对医疗器械进行网络安全风险评估,识别潜在的网络安全威胁和漏洞,并制定相应的缓解措施。
依据:MDR附件一列出了针对具有网络安全风险的设备的一般安全和性能要求(GSPR)。
2. 技术文档
内容:技术文档中应包含网络安全相关的内容,如网络安全设计、验证和确认测试的结果、网络安全风险评估报告等。
依据:MDR要求制造商提供详细的技术文档以支持其产品的安全性和有效性。
3. 上市后监测计划
内容:制造商应制定上市后监测计划,以持续监控设备的网络安全状况,并及时应对任何发现的网络安全问题。
依据:MDR要求制造商在设备上市后继续进行监测和评估。
三、总结
医疗器械在欧美上市时,需要提交的网络安全相关申报文件主要包括网络安全管理计划、设计开发与维护流程、软件物料清单(SBOM)、网络安全风险评估报告、技术文档以及上市后监测计划等。这些文件旨在确保医疗器械在上市前和上市后都能满足网络安全要求,保护患者和医疗机构的数据安全。(以上信息可能随时间而变化,建议在实际操作前查阅最新的法律法规和监管机构的指导文件。)
--------
网安云,目针对医疗器械海外国内注册、变更推出网络安全解决方案,专业安全专家与法规研究团队对国内、美国、欧盟等国家医疗器械注册网络安全要求进行深入钻研,为客户定制化网络安全方案,帮助客户为设备注册、上市出具符合法规要求的网络安全文件。
点击了解更多。
医疗器械网络安全顾问![]() https://www.wanyun.cn/Support?share=24315_ea8a0e47-b38d-4cd6-8ed1-9e7711a8ad5e
https://www.wanyun.cn/Support?share=24315_ea8a0e47-b38d-4cd6-8ed1-9e7711a8ad5e