在细胞生物学中,基因表达调控是决定细胞功能与命运的核心过程之一。组蛋白作为修饰性蛋白,在调控基因转录中起着至关重要的作用。近年来,科学家们发现,组蛋白的多种化学修饰(如甲基化、乙酰化、磷酸化等)影响基因的表达状态。其中,组蛋白乳酸化作为一种新近发现的修饰,引起了广泛关注。
组蛋白乳酸化是由代谢副产物乳酸直接调控的,这一过程不仅涉及组蛋白的结构改变,还可能对其功能起到调节作用。与此同时,RNA甲基化作为一种重要的转录后修饰,已经被证明在调控基因表达、RNA稳定性和翻译效率等方面起着关键作用。RNA甲基化的变化对细胞的代谢状态、发育过程以及肿瘤形成等诸多生物学进程产生深远影响。
最近一些研究表明,组蛋白乳酸化与RNA甲基化之间可能存在某种形式的相互作用,为理解基因表达的复杂调控网络提供了新视角。
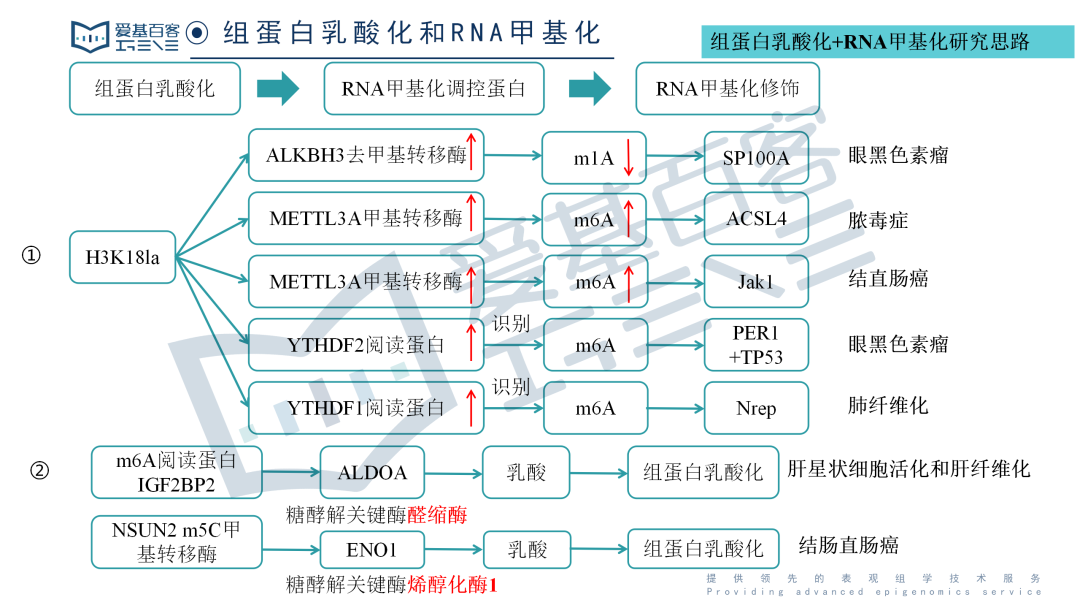
◆组蛋白乳酸化和RNA甲基化修饰的联合思路主要有两种方向:
-
组蛋白乳酸化影响RNA甲基化相关的调控蛋白(诸如甲基转移酶、去甲基转移酶和阅读蛋白)的表达水平,然后调控蛋白又进一步影响相应的RNA甲基化修饰水平,进而影响相应的表型;
-
RNA甲基化相关调控蛋白影响糖酵解代谢相关酶(比如醛缩酶和烯醇化酶1)的表达水平,进而影响乳酸的产量,进而影响组蛋白乳酸化水平,最后影响相应的生物学功能。
我们再来看看具体的案例。
思路一:
组蛋白乳酸化——RNA甲基化调控蛋白——RNA甲基化修饰
-
案例1: 组蛋白乳酸化促进的ALKBH3通过SP100A的m1A去甲基化促进肿瘤进展并减少早幼粒细胞白血病蛋白核缩合物[1]

-
研究单位:上海交通大学医学院附属第九人民医院
-
样本类型:人眼黑色素瘤组织
-
发表期刊:Nucleic Acids Res(IF=16.6)
-
发表时间:2024
-
研究对象:H3K18la+m1A
-
研究技术:ChIP-seq,CUT&Tag,WB,免疫荧光等
-
研究内容:
尽管N1-甲基腺苷(m1A)RNA修饰是RNA代谢的重要调节因子,但m1A修饰在癌症发生中的作用仍然不明。在这里,研究发现组蛋白乳酸化增强了ALKBH3的表达,同时通过去除SP100A的m1A甲基化减弱了肿瘤抑制性前髓细胞白血病蛋白(PML)凝聚体的形成,从而促进了癌症的恶性转化。首先,由于过量的组蛋白乳酸化水平,ALKBH3在高风险眼黑色素瘤中被特异性上调,这与m1A低甲基化状态有关。此外,多组学分析随后确定SP100A作为PML体的核心组成部分,作为ALKBH3的下游候选靶点。在治疗上,ALKBH3的沉默在黑色素瘤中显示出良好的治疗效果,包括体外和体内实验,而这一效果可以通过消耗SP100A来逆转。
在机制上,研究团队发现YTHDF1负责识别m1A甲基化的SP100A转录本,这增加了其RNA稳定性和翻译效率。最后,研究首次证明了m1A修饰对肿瘤抑制基因表达是必要的,从而拓展了当前对肿瘤进展中动态m1A功能的理解。此外,研究结果表明,乳酸化驱动的ALKBH3对PML核凝聚体的形成至关重要,这架起了我们对m1A修饰、代谢重编程和相分离事件的理解的桥梁。
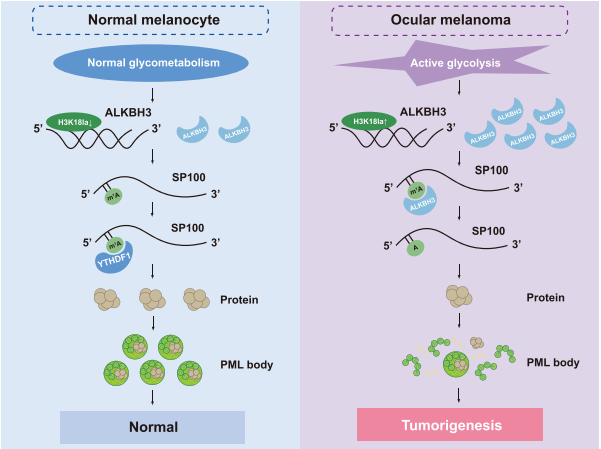
-
案例2: 组蛋白乳酸化调控的METTL3通过对ACSL4的m6A修饰促进脓毒症相关肺损伤中的铁死亡[2]

-
研究单位:复旦大学
-
样本类型:小鼠肺上皮细胞
-
发表期刊:Redox Biol(IF=10.07)
-
发表时间:2024
-
研究对象:H3K18la+m6A
-
研究技术:ChIP-qPCR, WB, 免疫荧光等
-
研究内容:
乳酸水平升高是脓毒症的重要生物标志物,并与脓毒症相关的死亡率呈正相关。脓毒症相关肺损伤(ALI)是临床患者预后不良的主要原因。然而,乳酸在脓毒症相关ALI中的具体作用机制仍不清楚。
在这项研究中,研究展示了乳酸通过促进p300介导的H3K18la与METTL3启动子结合,调节N6-甲基腺苷(m6A)修饰水平。METTL3介导的m6A修饰在ACSL4中富集,其mRNA的稳定性通过依赖于YTHDC1的途径进行调节。此外,短期乳酸刺激上调ACSL4,从而促进线粒体相关的铁死亡。通过敲低或靶向抑制METTL3,有效抑制了脓毒症引起的高乳酸诱导的肺泡上皮细胞铁死亡,并减轻了脓毒症小鼠的肺损伤。研究结果表明,在脓毒症相关的ALI中,乳酸通过GPR81/H3K18la/METTL3/ACSL4轴诱导肺泡上皮细胞的铁死亡。这些结果揭示了一种由组蛋白乳酸化驱动的机制,通过METTL3介导的m6A修饰诱导铁死亡。靶向METTL3代表了一种有前景的治疗策略,适用于脓毒症相关的ALI患者。
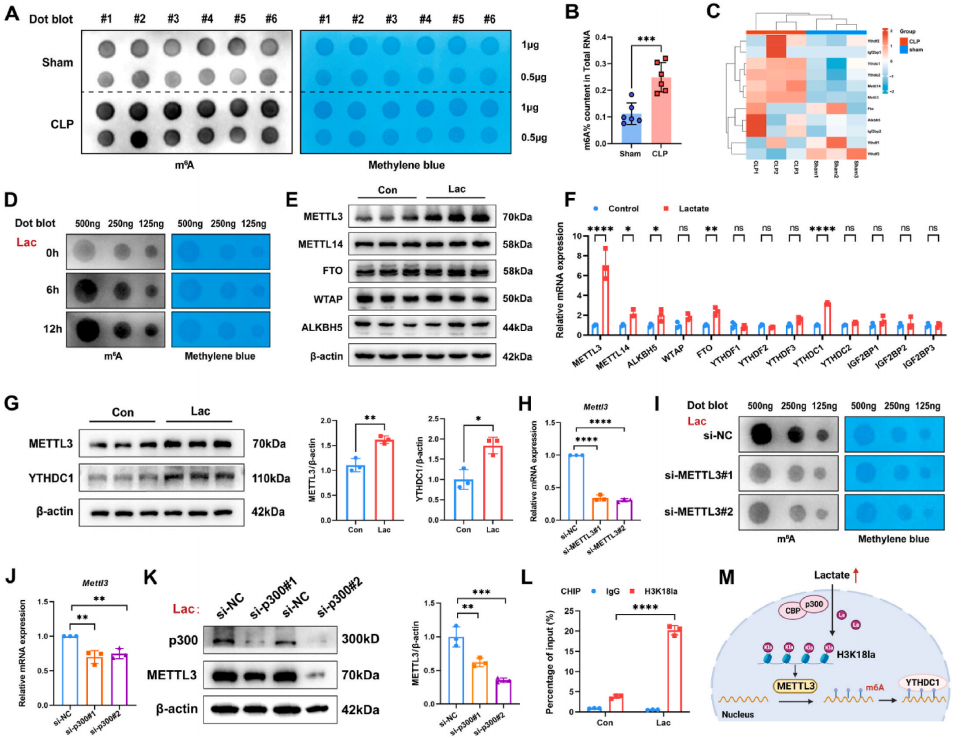
图:乳酸/H3K18la轴上调METTL3,增加m6A修饰。
-
案例3:组蛋白乳酸化通过促进m6A阅读蛋白YTHDF2在眼部黑色素瘤中的表达来驱动肿瘤的发生[3]

-
研究单位:上海交通大学医学院附属第九人民医院
-
样本类型:人眼部黑色素瘤细胞系
-
发表期刊:Genome Biol(IF=10.1)
-
发表时间:2021
-
研究对象:H3K18la+m6A
-
研究技术:ChIP-seq
-
研究内容:
组蛋白乳酸化是一种与代谢压力相关的组蛋白修饰,在M1巨噬细胞极化过程中对基因表达的调控扮演着重要角色。然而,组蛋白乳酸化在肿瘤发生中的作用仍不明确。该研究发现肿瘤中的组蛋白乳酸化水平升高,并且与眼部黑色素瘤的不良预后相关。针对异常组蛋白乳酸化的修正可以在体外和体内激发治疗效果。从机制上讲,组蛋白乳酸化H3K18la通过促进YTHDF2的表达来促进肿瘤发生。此外,YTHDF2识别经过m6A修饰的PER1和TP53 mRNA,并促进它们的降解,这加速了眼部黑色素瘤的肿瘤发生。研究揭示了组蛋白乳酸化的致癌作用,从而为眼部黑色素瘤的治疗提供了新的治疗靶点。同时,研究将组蛋白修饰与RNA修饰联系起来,提供了对肿瘤发生中表观遗传调控的新理解。
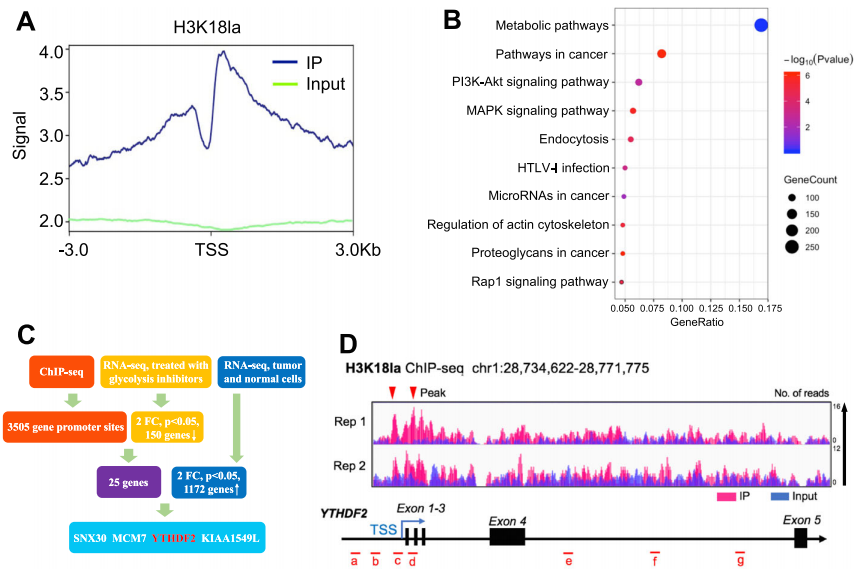
图:组蛋白乳化激活了YTHDF2的转录。
思路二:
RNA甲基化调控蛋白——RNA甲基化修饰水平——糖酵解相关酶——乳酸——乳酸化水平
-
案例4:m6A阅读蛋白IGF2BP2调节糖酵解代谢,介导组蛋白乳酸化,以增强肝星状细胞活化和肝纤维化

-
研究单位:兰州大学
-
样本类型:人肝星形细胞
-
发表期刊:Cell Death Dis(IF=8.1)
-
发表时间:2024
-
研究对象:m6A+H3K18la
-
研究技术:WB, 免疫荧光
-
研究内容:
关于N6-甲基腺苷(m6A)修饰在肝纤维化病因和进展中的作用的证据逐渐增加,并且其作为治疗靶点的前景广阔。胰岛素样生长因子2(IGF2)mRNA结合蛋白2(IGF2BP2)是新发现的m6A结合蛋白,能够增强mRNA的稳定性和翻译。然而,它在肝纤维化中的作为m6A结合蛋白的作用仍不明确。
在这项研究中,研究团队观察到IGF2BP2在肝纤维化和活化的肝星形细胞(HSCs)中高表达,并且抑制IGF2BP2能够保护HSCs免受激活和肝纤维生成的影响。从机制上讲,作为m6A结合蛋白,IGF2BP2调节糖酵解代谢途径中的关键靶点醛缩酶A(ALDOA)的表达,从而调控HSCs的激活。此外,研究团队观察到活化的HSCs中的活跃糖酵解代谢会产生大量乳酸,为组蛋白乳酸化提供底物。重要的是,组蛋白乳酸化会改变HSCs的激活表型。总之,研究结果揭示了IGF2BP2在肝纤维化中的重要作用,通过调节糖酵解代谢,强调了靶向IGF2BP2作为肝纤维化治疗方法的潜力。
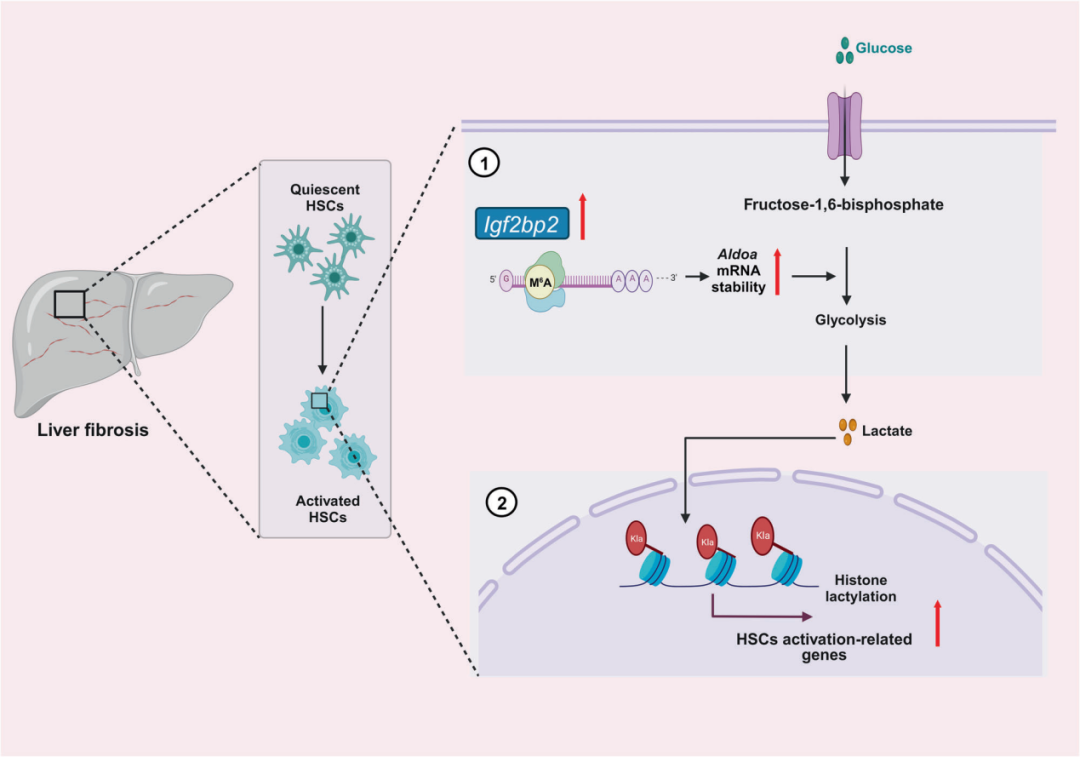
图:IGF2BP2和组蛋白乳酸化在肝纤维化中的机制示意图模型。
-
案例5:NSUN2介导的m5C修饰的代谢编码通过NSUN2/YBX1/m5C-ENO1正反馈回路促进结肠直肠癌的进展

-
研究单位:武汉大学中南医院
-
样本类型:结直肠癌细胞
-
发表期刊:Adv Sci(IF=14.3)
-
研究对象:m5C+H3K18la
-
研究技术:WB,ChIP-qPCR
-
研究内容:
RNA修饰5-甲基胞嘧啶(m5C)近年来作为基因表达的重要转录后调控因子而备受关注,并与多种肿瘤发生过程密切相关。然而,目前关于m5C修饰在结直肠癌(CRC)发生和进展中的具体机制仍不清楚。
在这项研究中,发现m5C甲基转移酶NSUN2的表达显著升高,并在CRC中发挥致癌功能。从机制上讲,NSUN2和YBX1被确定为ENO1(糖酵解代谢酶)的“写入者”和“读取者”,NSUN2诱导的代谢重编程以m5C依赖性方式调控ENO1表达增强葡萄糖代谢,导致CRC细胞中乳酸产生增加。
这些来自CRC细胞的乳酸积累反过来通过组蛋白H3K18乳酸化(H3K18la)激活NSUN2的转录,并诱导NSUN2在Kys356位点(K356)的乳酸化,这对捕捉靶RNA至关重要。综上所述,这些发现揭示了一个有趣的正反馈循环,涉及NSUN2/YBX1/m5C-ENO1信号通路,从而联系起代谢重编程和表观遗传重塑,这可能为将NSUN2抑制剂与免疫疗法结合用于CRC的治疗潜力提供新的见解。
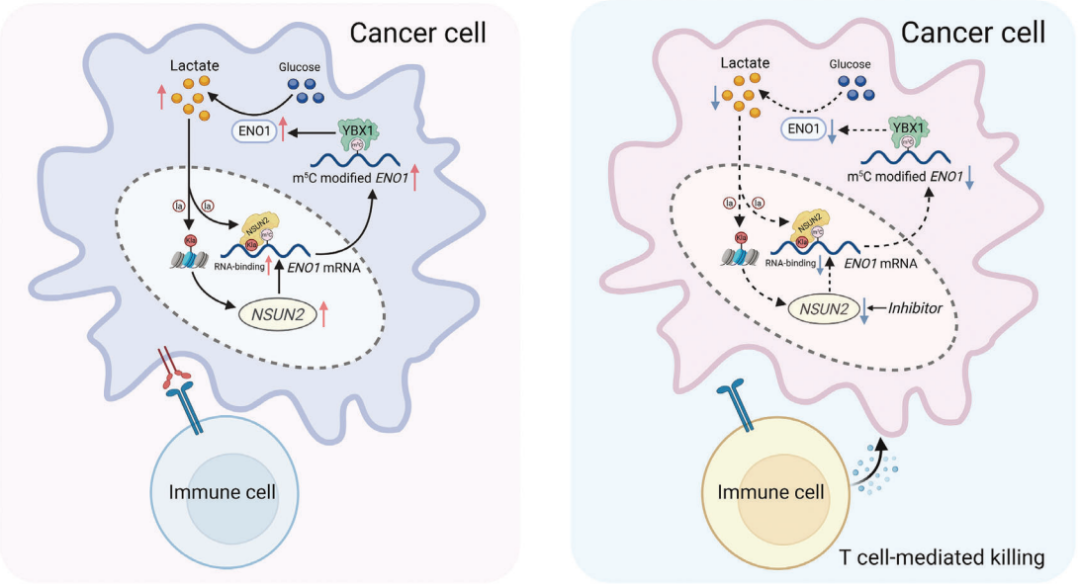
图:研究机制示意图
「 爱基小结 」
组蛋白乳酸化和RNA甲基化都是重要的表观遗传修饰,作为热门的修饰类型,近几年备受基金项目和期刊的青睐。本期,我们分享了组蛋白乳酸化和RNA甲基化联合的思路案例,这些案例不仅展示了这两种修饰在细胞代谢及疾病发生中的协同作用,还揭示了它们如何共同影响基因表达的复杂网络。希望我们的分享能对大家的科研思路有启发,如有组蛋白乳酸化和RNA甲基化的技术咨询,欢迎联系我们~
-
参考文献
[1] GU, Xiang, et al. Histone lactylation-boosted ALKBH3 potentiates tumor progression and diminished promyelocytic leukemia protein nuclear condensates by m1A demethylation of SP100A. Nucleic Acids Research, 2024, 52.5: 2273-2289.
[2] WU, Dan, et al. Histone lactylation-regulated METTL3 promotes ferroptosis via m6A-modification on ACSL4 in sepsis-associated lung injury. Redox Biology, 2024, 74: 103194.
[3] YU, Jie, et al. Histone lactylation drives oncogenesis by facilitating m 6 A reader protein YTHDF2 expression in ocular melanoma. Genome biology, 2021, 22: 1-21.
[4] ZHOU, Yongqiang, et al. The m6A reader IGF2BP2 regulates glycolytic metabolism and mediates histone lactylation to enhance hepatic stellate cell activation and liver fibrosis. Cell Death & Disease, 2024, 15.3: 189.
[5] CHEN, Baoxiang, et al. Metabolic Recoding of NSUN2‐Mediated m5C Modification Promotes the Progression of Colorectal Cancer via the NSUN2/YBX1/m5C‐ENO1 Positive Feedback Loop. Advanced Science, 2024, 2309840.