小罗碎碎念
本期推文主题:鼻咽癌综述
这篇文章提供了一个全面的综述,探讨了鼻咽癌(NPC)的关键研究进展,包括病理机制、治疗、筛查和生物标志物的发展。

文章首先强调了NPC在特定地理区域的流行情况,并讨论了过去几十年中一些地区NPC发病率和死亡率的下降趋势。此外,文章还概述了NPC的三种主要亚型,并强调了遗传和环境因素,特别是EB病毒(EBV)在NPC发病中的关键作用。
接着,文章深入探讨了NPC治疗的最新进展,包括放疗技术的进步、化疗方案的优化以及免疫治疗的新兴策略。特别指出了诱导化疗在提高局部晚期NPC患者生存率方面的益处,以及同步放化疗作为标准治疗手段的重要性。此外,还讨论了液体活检如循环EBV DNA在疾病监测和治疗反应评估中的应用。
最后,文章讨论了NPC研究中的一些挑战和争议,并提出了对未来研究方向的见解。作者强调了需要更多的研究来确定最佳的治疗方案,包括化疗与放疗的最佳序列、治疗持续时间以及预测生物标志物的角色,以指导个体化治疗。同时,文章也展望了通过精准医学和个体化治疗策略来改善NPC患者预后的未来可能性。
一、引言
鼻咽癌(NPC)在华南地区、东南亚和北非地区具有地方性流行特征,根据GLOBOCAN的数据,这些区域年龄标准化发病率为每10万人4至25例,较世界其他地区高出50至100倍1,2。
过去30年中,一些流行区如香港、新加坡和台湾的鼻咽癌发病率和死亡率有所下降3-5。例如,香港男性鼻咽癌死亡率从2002年至2012年下降了31.3%5。然而,在中国大陆南部的一些省份,鼻咽癌的发病率在过去二十年中保持稳定6。某些地区鼻咽癌发病率和死亡率的降低趋势,归因于饮食模式的变化、社会经济发展状况的提升以及疾病管理的改善等多种因素5。
本综述全面、跨学科地概述了关于鼻咽癌发病机制、治疗、筛查和生物标志物开发的关键研究成果,这些成果促进了鼻咽癌患者治疗结局的改善。
此外,本文提供了历史背景,以说明这些进展对当前鼻咽癌管理的影响。最后,作者还强调了鼻咽癌在临床前和临床研究中存在的挑战和争议,旨在为未来的研究提供洞见。
二、鼻咽癌(NPC)的发病机制
鼻咽癌可分为三种亚型:
- 角化鳞状细胞癌
- 非角化鳞状细胞癌
- 未分化或低分化癌
在流行区,非角化亚型占NPC的95%以上,而在美国则占75%8;这种独特的地理分布归因于遗传和环境因素的共同作用9–12。
针对高风险华南人群的连锁分析和全基因组关联研究显示,某些HLA单倍型和位于6p21染色体上MHC I类分子编码区的多个生殖系变异与NPC的遗传易感性相关13,14。与非角化NPC的普遍感染不同,Epstein-Barr病毒(EBV)在此亚型中具有关键的致病作用。
在中国南部,两个非同义BALF2变异与NPC的高风险发展相关,这些变异与此地区约83%的NPC总风险相关15。
独特的遗传因素与EBV变异的相互作用可能由于影响宿主免疫应答和/或病毒裂解再激活,从而增加了持续感染和EBV感染上皮细胞克隆扩增的风险。
EBV对B细胞和上皮细胞都有亲嗜性,尽管在非恶性的鼻咽上皮细胞中无法检测到EBV基因组或病毒蛋白,表明获得性遗传改变和细胞因素对于维持持续潜伏感染至关重要16。
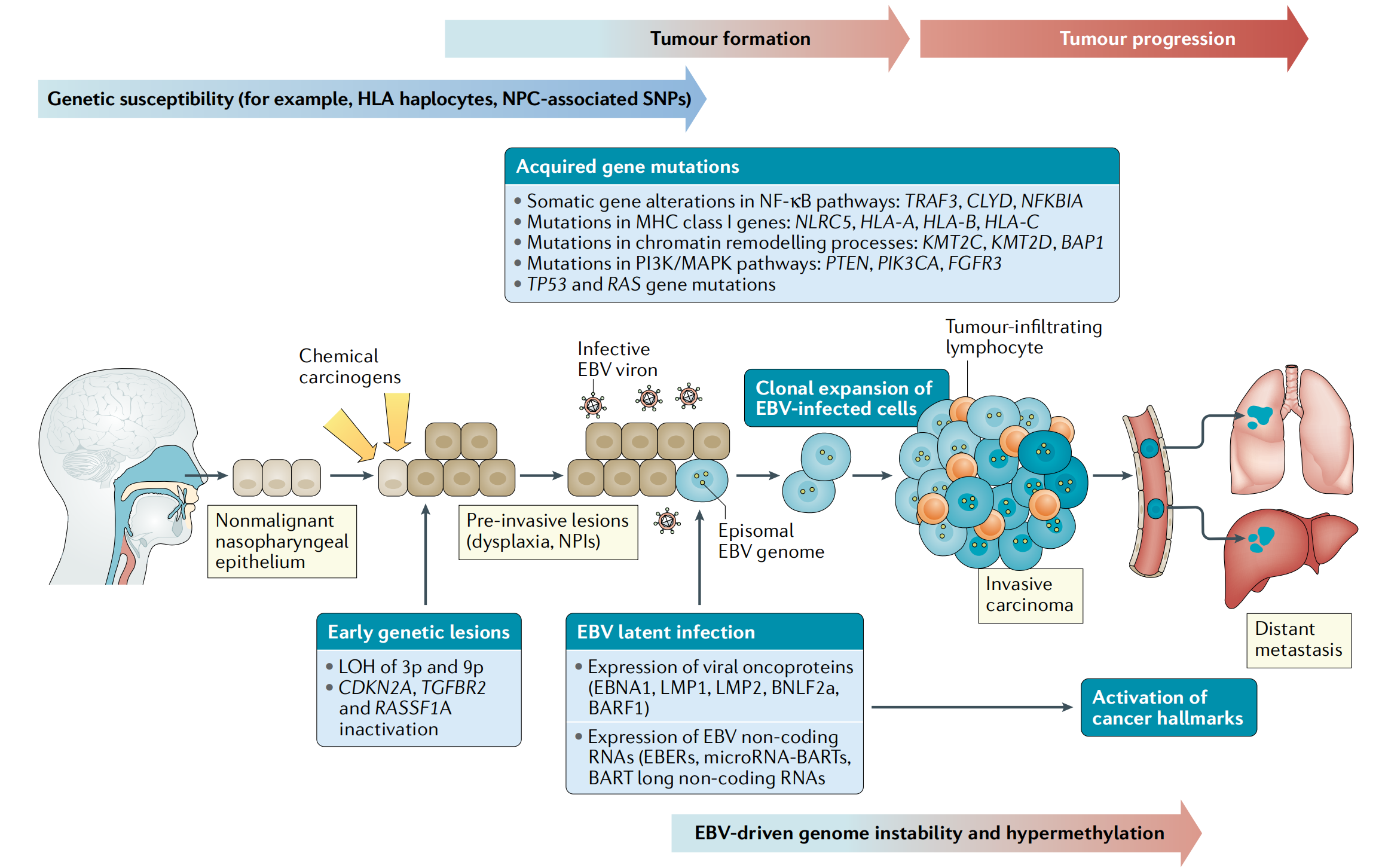
数十年的研究促成了一个假设性NPC发病模型的建立,该模型认为遗传易感的鼻咽上皮细胞在获得持续潜伏EBV感染和表达多种病毒致癌蛋白及非编码RNAs后,发生恶性转化,从而实现细胞转化和克隆扩增(图1)。
图1提出了一个关于鼻咽癌(NPC)发病机制的假设模型,具体分析如下:
-
环境致癌物暴露:首先,环境因素中的致癌物暴露会诱发遗传性损伤,例如3号染色体短臂§和9号染色体上的缺失。
-
肿瘤抑制基因失活:这些遗传损伤会导致关键的肿瘤抑制基因失活,如CDKN2A和TGFBR2,这些基因的失活会使鼻咽上皮细胞更容易受到EBV的感染和转化。
-
EBV感染与细胞转化:EBV感染后,病毒基因组以环状游离DNA(episomal viral genomes)的形式存在,并在鼻咽上皮细胞中表达潜伏II型蛋白(如EBNA1、LMP-1和LMP-2)和非编码RNA(包括EBERs、microRNA-BARTs和BART长非编码RNA),这些表达产物促进了基因组不稳定、全基因组DNA甲基化,并激活了几乎所有的癌症标志。
-
克隆扩增与遗传/表观遗传事件累积:EBV转化的鼻咽上皮细胞的克隆扩增导致多种遗传和表观遗传事件的累积,这些事件推动了NPC的发展。
-
肿瘤微环境与免疫逃逸:体细胞基因组的改变(如NF-κB途径的突变和抗原呈递机制组分的改变)与EBV潜伏基因的表达(例如LMP-1和BNLF2a)共同调节肿瘤微环境,促进免疫逃逸。
-
肿瘤进展与其他遗传改变:其他获得性遗传改变,包括TP53基因的改变、涉及染色质重塑的基因以及PI3K-MAPK途径组分的改变,这些都有助于肿瘤的进展、局部复发和远处转移的发生。
-
免疫相关因素:HLA(人类白细胞抗原)和MHC(主要组织相容性复合体)在免疫反应中起关键作用,而LOH(杂合性丧失)和SNP(单核苷酸多态性)是遗传变异的形式,可能影响个体对疾病的易感性和治疗反应。
这个模型强调了遗传、表观遗传、病毒和免疫因素在NPC发病机制中的相互作用,并指出了潜在的治疗靶点和生物标志物。
随后遗传和表观遗传事件的累积导致了侵袭性表型的形成,促进NPC的进展17,18。
NPC致癌作用早期的驱动事件包括细胞周期D1–Rb途径的失调(例如,通过CCND1过表达或CDKN2A的纯合缺失)和肿瘤抑制基因(如TGFBR2)的失活,这些事件通过促进持续潜伏EBV感染而有助于肿瘤的起始18–21。
EBV的 episomal 基因组和Latency II基因的表达,编码多种病毒癌蛋白(EBNA1、LMP-1和LMP-2A)和非编码RNAs(Epstein–Barr病毒编码的小RNAs(EBERs)和microRNA-BARTs),促进宿主基因组的全局表观遗传改变,最终影响包括无限细胞生长、凋亡抵抗、免疫逃逸、促瘤炎症和基因组不稳定性在内的多种癌症特征18。
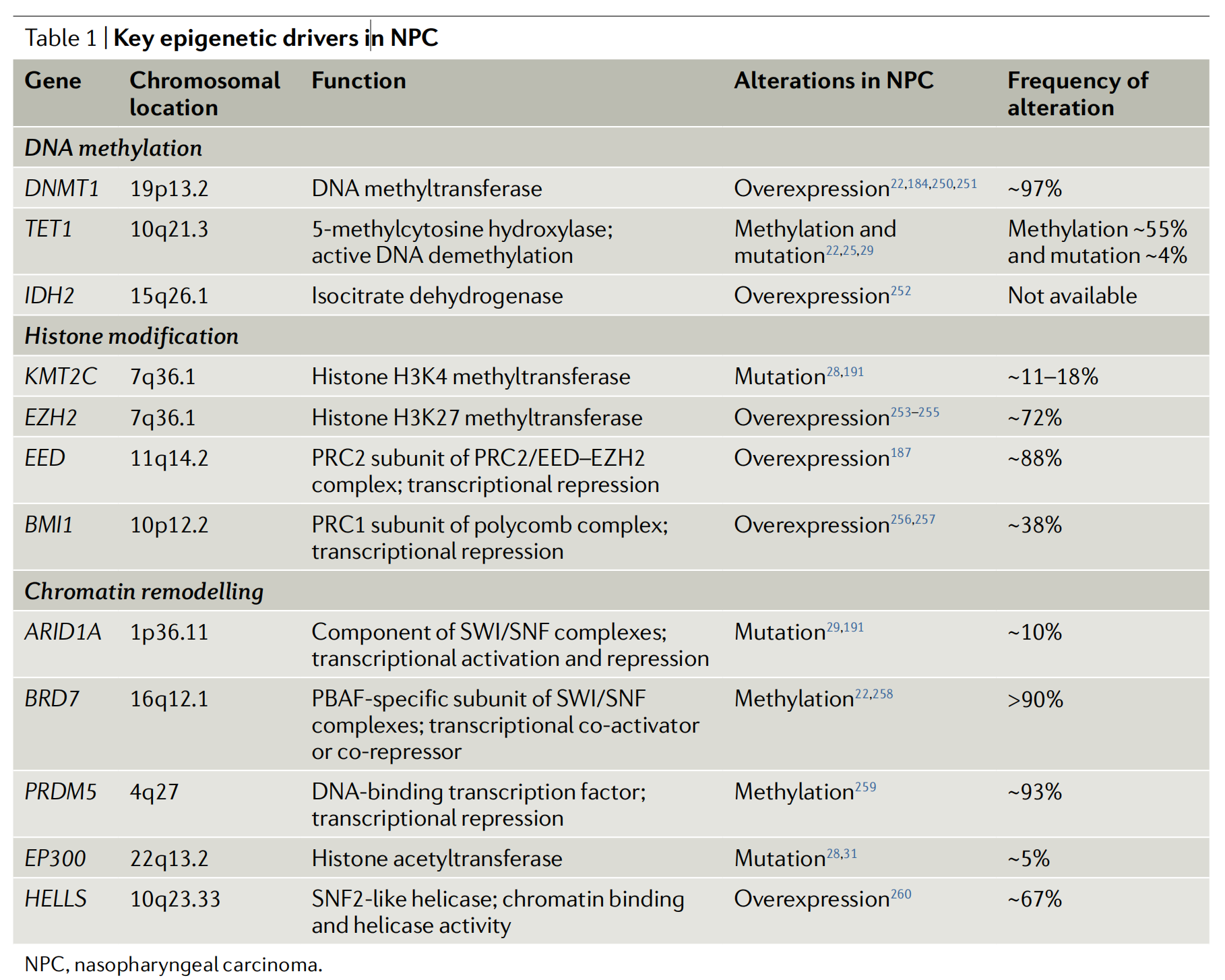
实际上,EBV驱动的全局细胞DNA甲基化,导致多个肿瘤抑制基因(如TET1、CDKN2A、RASSF1、RASAL1、PCDH10、ZNF382、DLEC1和ZBTB28)的基因组范围表观遗传沉默,已有充分的文献记录22–26,表明EBV诱导的表观遗传修饰在NPC的分子发病机制中扮演关键角色(表1)。
表1列出了鼻咽癌(NPC)中的关键表观遗传驱动因素,包括它们的染色体位置、功能、在NPC中的变异类型以及变异的频率。
-
基因名称:列出了与NPC相关的表观遗传调控基因。
-
染色体位置:每个基因在人类染色体上的特定位置。
-
功能:简要描述了每个基因在细胞中的生物学功能。
- DNA甲基化:涉及基因表达调控的关键过程,如DNA甲基转移酶(DNMT1)的过表达。
- 组蛋白修饰:影响染色质结构和基因表达,如组蛋白H3K4甲基转移酶(KMT2C)的突变。
- 染色质重塑:改变染色质结构,从而调节基因的可及性和表达,如SWI/SNF复合体的组成部分(ARID1A)。
-
变异类型:基因在NPC中的变异类型,包括:
- 甲基化:基因启动子区域的过度甲基化,导致基因沉默。
- 突变:基因序列的改变,可能影响其编码蛋白的功能。
- 过表达:基因表达水平的增加,可能导致细胞功能的改变。
-
变异频率:这些变异在NPC患者中的发生率,以百分比表示。
具体基因和变异情况如下:
- DNMT1:位于19p13.2,作为DNA甲基转移酶,通常在NPC中过表达,变异频率约为97%。
- TET1:位于10q21.3,作为5-甲基胞嘧啶羟化酶,参与DNA主动去甲基化,通常发生甲基化和突变,变异频率分别为约55%和4%。
- IDH2:位于15q26.1,作为异柠檬酸脱氢酶,通常过表达,但文中未提供具体变异频率。
- KMT2C、EZH2、EED、BMI1:这些基因参与组蛋白修饰,通常发生突变或过表达。
- ARID1A、BRD7、PRDM5、EP300、HELLS:这些基因参与染色质重塑,通常发生突变或甲基化。
表1强调了表观遗传学在NPC发病机制中的重要性,并指出了可能的治疗靶点。这些基因的变异可能影响细胞的生长、分化和凋亡等过程,从而导致肿瘤的发生和发展。
全外显子测序和全基因组测序研究显示,NF-κB信号通路的失调,由编码该通路成员的基因的各种体细胞改变和/或EBV编码蛋白LMP-1的过表达引起,是NPC的主要致癌驱动因素18,27–29。此外,全外显子和全基因组测序研究揭示,NPC中的免疫逃逸通常是由损害抗原呈递机制的体细胞改变(例如,NLRC5和HLA的失活突变)驱动28,或通过EBV编码的抗原肽转运蛋白1和2(TAP1和TAP2)的抑制剂BNLF2a的过表达30。
影响多种癌症特征的细胞-病毒相互作用可促进NPC的进展。
尽管与其他头颈部癌症相比(约85%),NPC中的TP53突变发生率较低(5.3%至9.5%),但在复发性或转移性(R/M)NPC中TP53突变的一致性检测频率高于原发性NPC(15.2%对6.4%),表明其在癌症进展中可能发挥作用28。
全外显子测序研究揭示了TGFBR2在NPC原发肿瘤和肿瘤衍生细胞系中的频繁体细胞改变21,31。这些新发现支持了TGFβ–Smad信号通路在NPC肿瘤发生中的驱动作用。其他重要的获得性遗传事件包括调节表观遗传修饰或染色质重塑的基因改变(表1)、细胞周期控制以及PI3K–AKT和MAPK通路18,20,28。近年来,单细胞RNA转录组学的进步为肿瘤微环境中免疫细胞的瘤内异质性提供了洞见32,33。这些基因组学研究提出了在NPC中具有临床相关性的生物标志物和新的治疗靶点。
尽管全基因组测序研究广泛,但CpG甲基化相关的基因沉默仍是NPC中最常见的遗传改变34。
多项表观遗传组学研究导致了一系列在NPC中频繁甲基化的癌症基因(包括新发现或已确立的)的识别。这些基因包括细胞信号传导和表观遗传修饰调节因子(表1),表明病毒诱导的表观遗传异常在NPC的发病机制中具有关键作用。
总结而言,NPC的发病机制涉及遗传易感性、EBV感染、表观遗传学改变以及细胞信号通路的失调。这些因素共同作用于鼻咽上皮细胞,导致其恶性转化和肿瘤进展。尽管全基因组测序技术揭示了NPC中的多种遗传和表观遗传改变,但CpG甲基化相关的基因沉默仍是最普遍的遗传改变,突显了病毒诱导的表观遗传异常在NPC发病中的重要性。
这些研究不仅为理解NPC的分子机制提供了深入见解,而且为开发新的诊断生物标志物和治疗靶点奠定了基础。
三、鼻咽癌的筛查
在鼻咽癌(NPC)流行地区,如香港,超过50%的患者在就诊时已处于晚期(根据美国癌症联合委员会第七版分类,为III–IV期疾病)(补充表1)。
早期鼻咽癌具有较高的可治愈性,而在流行人群中通过EB病毒(EBV)筛查可以提高NPC的分期分布并降低癌症相关死亡率。基于血清中EBV抗体检测的连续几代筛查方法,结合高风险家族或人群的鼻内镜检查,已在队列研究中进行了测试(36–41)。这些血清学检测的诊断性能根据所使用的检测方法和试剂而有很大差异,敏感性介于40.9%至92.7%之间(41)。
2019年报告了一项基于人群的、集群随机筛查试验(PRO-NPC-001)的结果,该试验在中国南方70,296名参与者中结合了抗VCA和抗EBNA1抗体的血清学检测以及间接镜检鼻咽部和/或淋巴腺触诊(42)。研究未能达到其主要终点,即筛查组(n=29,413)与对照组(n=50,636)相比降低NPC相关死亡率;然而,筛查组中I–II期NPC患者的比例高于对照组(79%对20.6%)。
作者使用实时定量PCR检测NPC患者血浆中的循环EBV DNA(43)。
这种方法在NPC筛查中的效用已在20,174名无症状个体的队列中进行了评估(44)。阳性测试结果的人员随后接受了鼻内镜和磁共振成像(MRI)检查。
与历史对照队列相比,接受筛查的个体在诊断时更可能患有I–II期疾病(71%对20%)并且3年无进展生存率(PFS)更高(97%对70%,P<0.001)(35)。在2020年发表的一项成本效益分析中,血浆EBV DNA和血清学检测的成本估计分别为20.36美元和16.50美元,尽管后一估计数未包括鼻咽部间接镜检和淋巴腺触诊的成本(42)。
重要的是,使用血浆EBV DNA筛查的个体中需要随访内镜检查的比例为1.5%,而使用血清学筛查的比例为3.9%,两种方法的阳性预测值分别为11.1%和4.8%。基于EBV DNA片段大小和甲基化模式分析的下一代筛查方法的研究数据显示,特异性可以提高,阳性预测值分别为19.6%和35.1%(47,48)。
MRI长期以来一直用于头颈部癌症的分期,并且在检测早期NPC方面也起到了内镜检查的补充作用(49)。
2011年开发(并于2020年更新)的基于MRI的分级系统可以使NPC的检测非常敏感,包括那些在咽隐窝、顶部和黏膜下或被良性增生掩盖而内镜检查无法看到的癌症(50,51)。
在第一项前瞻性研究中,比较了MRI和内镜检查的诊断性能,在一组无症状和有NPC(31%)的个体中,所有诊断的NPC中有10%仅通过MRI检测到(50)。
在第二项前瞻性研究中,这一比例在使用血浆EBV DNA筛查的无症状个体中上升至17.6%(49)。
此外,在275名参与者中,有三人患有生长缓慢的早期癌症,这些癌症在大约3年前通过MRI观察到,而在内镜下可见之前(49)。
未来,任何流行人群中NPC筛查的成功实施将取决于提高筛查测试的性能(例如,使用下一代测序平台进行血浆EBV DNA分析(47,52))和成本效益的努力,以及用于定位亚临床病变的成像工具的可用性。
四、局部区域晚期鼻咽癌的管理
4-1:历史概述
鼻咽癌是一种对放疗和化疗高度敏感的肿瘤类型。
由于其解剖位置的特殊性,放疗是非转移性疾病(即任何T,任何N,M0疾病)的主要治疗方法。化疗一般被认为是必要的,除了第I阶段的患者(根据AJCC第八版分类,为T1N0)。
如今,几乎所有的I–II期鼻咽癌患者都可以通过强度调制放疗(IMRT)加或不加化疗治愈:
- 5年总生存率(OS)分别为I期和II期的98%和92%
- 局部区域无失败生存率(FFS)分别为98%和94%
- 远处FFS分别为98%和91%53。
历史上,由于传统二维(2D)放疗后远处转移发生率高,III–IVA期患者的预后较差,根据20世纪90年代末期的研究报告,5年OS和PFS分别为58.6%和52.1%54。
在21世纪初期,治疗模式发生了两个重要变化,即在放疗中加入了同步化疗55,56,并逐渐从传统放疗技术转向IMRT20。具有里程碑意义的MAC-NPC荟萃分析显示,同步放化疗将5年OS和PFS提高至70.4%和61.1%55。在当前十年,诱导化疗重新引起了关注,多项试验表明,将其加入同步放化疗中可以带来OS的益处。
因此,局部区域晚期鼻咽癌患者的预后在过去三十年中得到了改善(图2)。
在鼻咽癌(NPC)的治疗中,诱导化疗(induction chemotherapy)指的是在放疗(radiotherapy)之前进行的化疗,其目的是缩小肿瘤的体积,提高放疗的效果。
近年来,诱导化疗重新引起了医学界的关注,因为多项临床试验的结果显示,将诱导化疗加入到同步放化疗(concurrent chemoradiotherapy)中,可以为患者带来总生存期(overall survival, OS)上的益处。
具体来说,这些试验发现:
- 诱导化疗能够减少肿瘤的负担,使得放疗更加有效。
- 通过在放疗前进行化疗,可以在治疗初期就对肿瘤细胞进行攻击,这可能有助于控制肿瘤的局部扩散和潜在的远处转移。
- 一些研究还表明,诱导化疗后的患者在接受同步放化疗时,可能会有更好的响应率和生存结果。
这种治疗方法的益处可能与以下因素有关:
- 肿瘤生物学:肿瘤在早期可能对化疗药物更敏感,诱导化疗可以在肿瘤较小、生物学行为可能较为局限时进行治疗。
- 治疗协同作用:化疗和放疗可能具有协同作用,化疗可以增加肿瘤细胞对放疗的敏感性。
- 患者选择:一些研究可能选择了具有特定特征的患者群体,这些患者可能从诱导化疗中获得更大的益处。
然而,这些结果需要通过更多的研究来验证,包括确定哪些患者群体最有可能从诱导化疗中获益,以及如何最佳地将诱导化疗整合到NPC的综合治疗方案中。
图2展示了III-IV期鼻咽癌(NPC)患者3年总生存率(3-year overall survival, OS)的趋势,这些患者接受了不同类型的治疗方案。
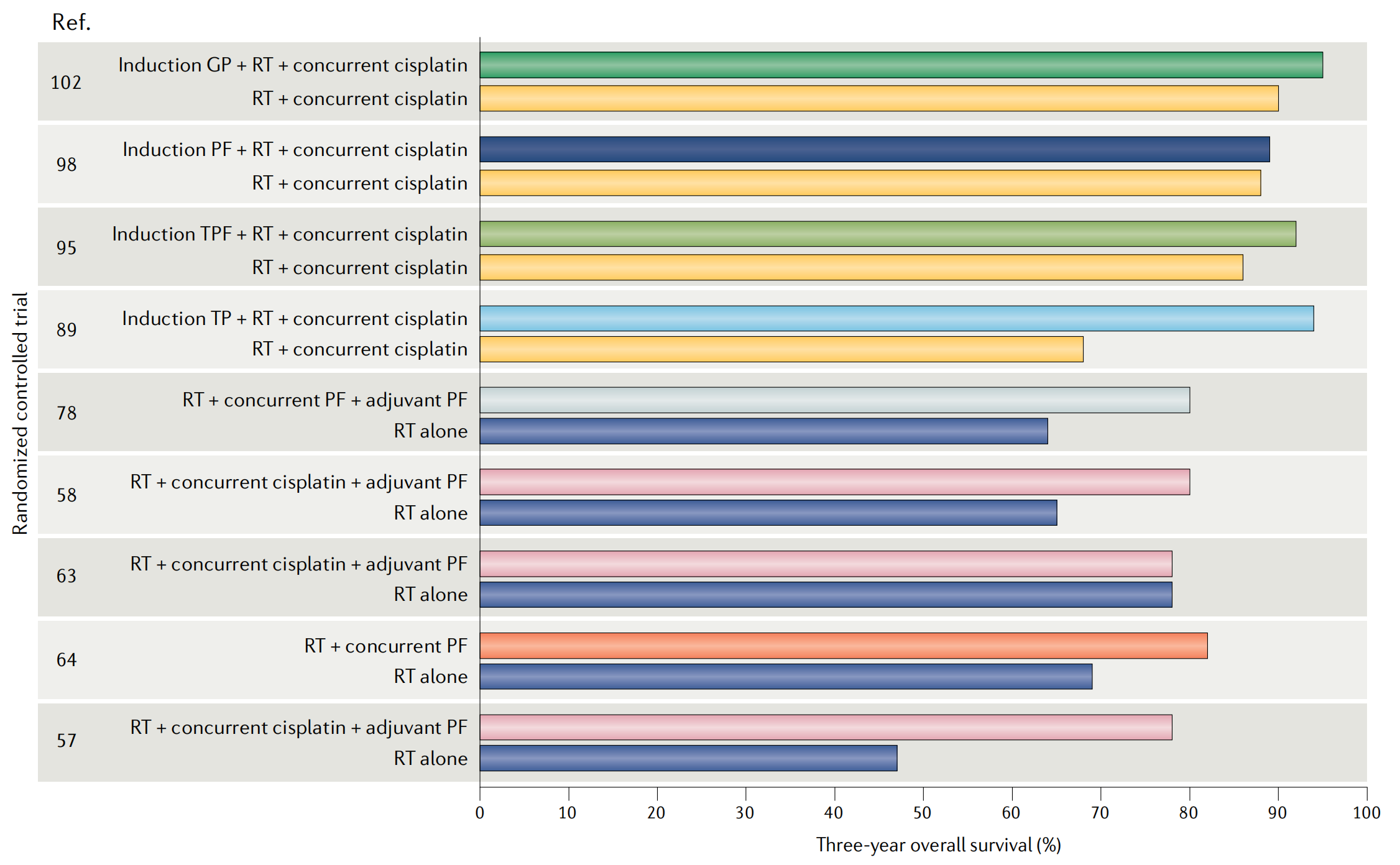
-
治疗方案缩写:
- GP:吉西他滨-顺铂(gemcitabine-cisplatin)方案。
- PF:顺铂-5-氟尿嘧啶(cisplatin-5-fluorouracil)方案。
- RT:放疗(radiotherapy)。
- TP:多西他赛-顺铂(docetaxel-cisplatin)方案。
- TPF:多西他赛-顺铂-5-氟尿嘧啶(docetaxel-cisplatin-5-fluorouracil)方案。
-
3年总生存率:图中列出了不同治疗方案对应的3年总生存率百分比,反映了患者在接受特定治疗后3年内存活的比例。
-
治疗趋势:从图中可以看出,随着治疗方案的改进和综合治疗策略的应用,患者的3年总生存率有所提高。例如,TPF方案相比单独放疗(RT alone)或顺铂-5-氟尿嘧啶(PF)方案,可能带来更高的生存率。
-
综合治疗的优势:图中的数据表明,将化疗与放疗结合使用(如TPF方案中的多西他赛、顺铂和5-氟尿嘧啶三药联合),可能比单一疗法或二药联合疗法有更好的疗效。
-
治疗方案选择:不同的治疗方案可能适用于不同的患者群体,这取决于患者的病情、耐受性和其他个体因素。图中的数据可以帮助医生和患者评估不同治疗方案的可能效果。
-
临床试验结果:图中的数据可能来源于不同的随机对照试验(Randomized controlled trial, RCT),这些试验结果为临床治疗提供了科学依据。
-
持续改进:图中显示的趋势强调了持续研究和改进治疗方案的重要性,以进一步提高NPC患者的生存率和生活质量。
4-2:同步放化疗
同步放化疗是目前非转移性III–IV期鼻咽癌的标准治疗方法。
INT-0099研究是第一个在非流行地区进行的III期临床试验,证明**在鼻咽癌治疗中加入同步和辅助化疗可以提高总生存率(OS)**57。后续在流行区域进行的随机对照试验58–63(补充表2)证实了这一发现。
在某些III期研究中,仅使用同步化疗而不使用辅助化疗也优于仅使用放疗64。2015年,MAC-NPC组在分析来自19项研究的约4800名患者的数据时,评估了同步化疗相对于单独放疗在非转移性II–IV期鼻咽癌中的OS益处(HR 0.79; P<0.0001)55。
统计学上显著的交互作用发生在化疗对OS益处和给药时机的影响上,倾向于同步加辅助化疗(HR 0.65, 95% CI 0.56–0.76)和仅同步化疗(HR 0.80, 95% CI 0.70–0.93),但不倾向于仅辅助化疗(HR 0.87, 95% CI 0.68–1.12)或仅诱导化疗(HR 0.96, 95% CI 0.80–1.16),相对于仅放疗55。
在任何顺序中加入化疗也改善了无进展生存率(HR 0.75, 95% CI 0.69–0.81)、局部区域控制(HR 0.73, 95% CI 0.64–0.83)、远处控制(HR 0.67, 95% CI 0.59–0.75)和癌症特异性死亡率(HR 0.76, 95% CI 0.69–0.84)55。
MAC-NPC组进行的网络荟萃分析利用了2017年前发表的研究中每位患者的数据,结果显示,同步放化疗后进行辅助化疗与仅放疗相比,具有最高的OS益处(HR 0.65, 95% CI 0.56–0.75)56。一些卡铂65,66、奥沙利铂67和奈达铂68的试验产生了有希望的结果;然而,大多数证据支持使用顺铂作为同步化疗。在剂量密度方面,根据AJCC第六版分期,II–III期鼻咽癌患者接受>5个周期的顺铂(每个周期40mg/m2)的OS(HR 0.44; P=0.02)显著优于接受<5个周期的患者69。
值得注意的是,治疗前血浆EBV DNA水平升高的I–II期鼻咽癌患者(>4000拷贝/ml;n =47)的预后通常比III期患者(n =95)更差70。
在一个使用中国1992年分期系统的III期研究中,II期鼻咽癌患者中13.4%的患者根据AJCC第七版分期为III期71,72,73。在平均随访5年后,顺铂同步放化疗在OS(HR 0.30; P=0.007)、PFS(HR 0.45; P=0.017)和远处转移无复发生存率(HR 0.27; P = 0.007)方面优于仅放疗。
一个涉及约2100名II期鼻咽癌患者的11项研究的荟萃分析显示,与仅放疗相比,顺铂同步放化疗在OS(HR 0.67; P=0.04)和局部区域复发无生存率(HR 0.61; P=0.0003)方面具有优势,尽管远处转移无复发生存率差异不具有统计学意义74。
作者注意到,在仅接受IMRT的患者亚组中,未能证明同步化疗的益处;一个可能的解释是,化疗在其他亚组中补偿了2D放疗的不足效果。
4-3:辅助化疗
尽管2017年MAC-NPC荟萃分析的结果表明,同步放化疗加辅助化疗可能优于单独使用任一治疗方法56,但一些专门研究辅助化疗加放疗的试验结果参差不齐(补充表3)75–78。
在迄今为止最大规模的研究中,根据AJCC第六版分期,III–IVB期鼻咽癌患者(除T3–T4N0外)被随机分配接受同步放化疗后观察或顺铂-5-氟尿嘧啶3个周期的治疗79。辅助治疗后晚期3–4级毒性的发生率并未增加;然而,5年的无失败生存率(FFS)并未提高(观察组75%,辅助治疗组71%;P=0.45)。
这项III期试验的结果与MAC-NPC荟萃分析的结果不一致,这可能反映了患者对辅助化疗的依从性较差(55–63%的患者完成了计划的辅助化疗周期)57,79,因此,需要更可耐受和有效的全身治疗。
一种方法是代谢化疗,涉及在长时间内频繁给予化疗药物,剂量较低,毒性较小80。在两项回顾性研究中,口服甲氨蝶呤加尿嘧啶的代谢化疗在局部区域晚期鼻咽癌患者中改善了OS和远处失败81,82。代谢化疗的作用目前正在一项正在进行中的III期试验(NCT02958111)中得到探讨,该试验中,III–IVA期鼻咽癌患者(除T3–4N0和T3N1外)被随机分配接受观察或辅助卡培他滨每日两次连续治疗,最长可达1年(NCT02958111)。
一些III期辅助化疗试验的负面结果的另一个可能原因与这些试验中选择的患者队列的异质性有关,这些队列在预后和复发风险方面存在差异75–77。确实,研究人员越来越多地使用血浆EBV DNA作为NPC的液体活检,以选择复发风险高的患者进行辅助化疗或免疫治疗。
4-4:诱导化疗
20世纪90年代和21世纪初期的许多研究比较了诱导化疗加放疗与仅放疗,其中一些研究揭示了疾病无复发生存率的改善,但并未提高总生存率(OS)83–88。
然而,这些研究使用的化疗方案大多已被当前实践所取代。随后,作者的团队和其他团队研究了在III–IVB期鼻咽癌中常用的化疗药物,如紫杉烷类、吉西他滨和卡培他滨89–91(补充表4)。
在一项II期研究中,III–IVB期鼻咽癌患者(根据国际癌症控制联盟1997年的分类)被随机分配接受同步放化疗加或不加两周期诱导多西他赛和顺铂89。在3年时,诱导化疗组OS显著优于对照组(HR 0.24; P=0.012)。两项II期试验评估了三周期TPF(多西他赛、顺铂和5-氟尿嘧啶)作为诱导治疗,在同步放化疗之前作为一种更加强烈的方法92,93。
在这些研究中,TPF与可管理的毒性反应和有希望的3年OS率(81.8–94.8%)相关92,93。在一项III期确认研究中,III–IV期鼻咽癌患者(除T3–4N0外,根据AJCC第七版分类)在同步放化疗中加入三周期诱导TPF后,3年OS(85.6%对77.7%;P=0.042)、远处无复发生存率(88%对79.8%;P = 0.03)和局部区域无复发生存率(90.7%对83.8%;P=0.044)均得到改善94,95。Frikha等人也在GORTEC 2006-02研究中证明了诱导TPF在非转移性T2b–T4/N1–N3 NPC患者中的益处96(补充表4)。
在另一项研究中,III–IVB期鼻咽癌患者(除T3N0–1外,根据AJCC第六版分类)接受诱导顺铂-5-氟尿嘧啶的患者比未接受诱导化疗的患者有更好的结果97,98。
有趣的是,诱导化疗组中眼部损伤的百分比显著低于对照组(P=0.029),这突出了在确定性放疗前通过肿瘤降期对局部区域晚期疾病的益处97,98。
相比之下,其他两项研究未能发现诱导化疗的OS益处。这些研究使用了三周期两种不同的多药方案:卡铂、吉西他滨和紫杉醇99;以及顺铂、丝裂霉素C、表柔比星、5-氟尿嘧啶和亚叶酸钙100(补充表4)。
一项III期研究显示,在姑息治疗中,铂-吉西他滨优于铂-5-氟尿嘧啶,因此,张等人研究了在III–IVB期疾病(根据第七版AJCC分类,除外N0疾病)患者中加入三周期诱导顺铂-吉西他滨对同步顺铂-IMRT的影响102。
在3年时,通过诱导化疗,复发无生存率(85.3%对76.5%;HR 0.51;P=0.001)和OS(94.6%对90.3%;HR 0.43,95% CI 0.24–0.77)均显著改善,且严重晚期毒性的发生率并未增加。
4-5:最佳治疗顺序和选择
2020年,MAC-NPC小组对局部区域晚期鼻咽癌中不同顺序和类型的化疗治疗的大量数据进行了总结,包括来自28项试验的8,221名患者的个体数据,并进行了更新后的网络荟萃分析103。
在中位随访7.2年时,以紫杉烷为基础的方案的诱导化疗后加同步放化疗(IC–CRT)被认为在OS上优于仅同步放化疗(HR 0.75, 95% CI 0.59–0.96; P-score 91%),其次是同步放化疗后加辅助化疗(CRT–AC; HR 0.92, 95% CI 0.69–1.24; P-score 95%)。当所有IC–CRT(无论是以紫杉烷为基础还是非紫杉烷为基础的方案)的试验被合并时,CRT–AC序列被认为是效用最高的,其次是IC–CRT,其P-score分别为93%和86%,CRT–AC与IC–CRT的HR为0.97(95% CI 0.84–1.14)。
四项其他荟萃分析支持了与仅同步放化疗相比使用诱导化疗的益处104–107。四项随机试验的个体患者数据合并分析显示,诱导化疗可改善III–IVB期患者的无进展生存率(HR 0.70)和OS(HR 0.75),这可能归因于远处失败率的降低(HR 0.68; P=0.008)105。
综合来看,这大量关于非转移性、III–IVA期鼻咽癌患者的数据(或许根据AJCC第八版分类的T3N0亚组除外)支持了诱导化疗后加同步放化疗的使用,这已成为该患者人群的新标准治疗。这一趋势体现在2021年发布的由CSCO和ASCO联合制定的指南中,该指南包括了对108项临床试验的系统回顾,这些试验评估了在II–IVA期NPC患者中诱导、同步和辅助化疗的使用108。
专家指导小组得出结论,在没有任何医学禁忌的情况下,可以给III–IVA期NPC患者提供五种不同的诱导方案90,92,95,96,98,99,103:
- 顺铂加吉西他滨
- 顺铂加5-氟尿嘧啶
- 顺铂加卡培他滨
- 顺铂加多西他赛
- TPF
诱导化疗的优势不仅在于改善生存率
实际上,研究表明,与辅助化疗相比,诱导化疗更有可能完成治疗——通过减少原发肿瘤的总体积并改善放疗中的肿瘤覆盖率,从而提高了肿瘤控制的可能性109,110。未来的诱导化疗研究可能涉及使用基因表达签名111或基于复合MRI的预后评分112来选择从诱导化疗中受益最多的患者亚组。
根据2020年的MAC-NPC荟萃分析,辅助化疗仍然是某些高风险复发患者的重要治疗选择,尽管进行了化疗和放疗,这些患者仍面临高复发风险,例如,那些在化疗和放疗后检测到血浆EBV DNA水平升高或对诱导化疗反应不佳的患者。这些辅助化疗的指征正在几个正在进行中的III期研究中得到探讨(NCT02135042, NCT02363400, NCT03544099 和 NCT04072107)。
另一个争议点涉及T3N0和T1–T2N1 NPC(根据AJCC第八版分类)患者的管理,由于缺乏专门针对这些亚组的III期研究。实际上,这些患者经常被排除在III期研究之外(补充表2, 3和4),因此他们通常仅接受化疗和放疗。仅凭TNM分期不足以对这些患者进行风险分层。
然而,根据第五版AJCC分类,治疗前血浆EBV DNA水平<4,000拷贝/ml的I–II期NPC患者的5年OS(91%)与I期患者的92%相似,而血浆EBV DNA水平≥4,000拷贝/ml的患者(64%)的5年OS甚至低于III期疾病患者(73%)113。
综上所述,鼻咽癌的治疗策略已经经历了显著的变革,特别是在局部区域晚期疾病的治疗上。诱导化疗加同步放化疗已成为标准治疗,特别是在III–IV期患者中。
辅助化疗仍然是一个重要的治疗选择,尤其是在那些即使经过化疗和放疗仍然有高风险复发的患者中。对于T3N0和T1–T2N1的患者,由于缺乏专门针对这些亚组的III期研究,目前尚无明确的标准治疗方案。未来的研究可能会进一步明确这些亚组患者的最佳治疗策略。
值得注意的是,随着医学研究的不断进展,治疗策略可能会继续更新。因此,临床医生需要密切关注最新的研究结果,并根据患者的具体情况和治疗反应来调整治疗方案。此外,随着个性化医疗的发展,未来的治疗策略可能会更加注重个体差异,以实现更有效的治疗效果。
五、放疗技术进步
5-1:放疗是治疗非转移性鼻咽癌以实现治愈的关键手段
过去几十年,基于光子的放疗技术逐渐发展,首先从二维(2D)发展到三维(3D)适形放疗,然后在21世纪初发展到强度调制放疗(IMRT)。IMRT通过更好的靶区覆盖和相邻器官的保护,相对于传统技术具有明显优势,这些优势已经被广泛报道20,115。
近年来,基于弧线的放疗方法,如容积调制弧形放疗(VMAT)和TomoTherapy,使用越来越多。VMAT是一种高度适形的放疗技术,它通过在治疗过程中连续调整机架旋转速度、多叶光栏位置和剂量率来实现强度调制,从而缩短治疗交付时间116,117。
一项研究比较了同时使用IMRT和VMAT的混合技术与各自单独使用时的效果,结果显示混合技术在靶区剂量均匀性和适形性方面表现更佳,且对脑干和脊髓的保护有所改善119。TomoTherapy通过在患者在机器中移动时以螺旋旋转方式使用调制的扇形束进行放疗120。
一项前瞻性非随机研究显示,与VMAT相比,接受TomoTherapy的头部和颈部癌症患者(其中38例为NPC)在18个月时的局部区域控制率(83.3%对72.7%;P=0.025)和癌症特异性生存率(97.2%对85.5%;P=0.014)更高,尽管两种治疗方式的总生存率差异不具有统计学意义120。
质子束和其他重带电粒子具有Bragg峰,其中剂量沉积最大;该峰在带电粒子完全停止之前出现,此峰之后的组织剂量极小(补充图1)。
质子治疗主要有两种类型:被动散射质子治疗(PSPT)和强度调制质子治疗(IMPT,也称为笔束扫描)。IMPT优于PSPT,因为它更适应头颈部癌症的复杂解剖结构。在这些癌症中,PSPT需要使用患者特定的装置(如补偿器),这些装置在制作和使用过程中既昂贵又耗时121,122。
一项对10名接受IMPT治疗的NPC患者的研究表明,IMPT在保护非恶性器官方面比IMRT更有效,在29个相邻器官中观察到13个器官的平均剂量更低;2年局部区域控制率为100%123。随后的质子治疗研究,无论是单独使用还是与光子治疗相结合,都显示了高的2年局部或局部区域控制率(84–94%)。
一些研究还表明质子治疗的患者急性毒性反应更轻124–127。此外,研究还提供了证据,表明质子治疗与IMRT相比,在头颈部原发肿瘤患者中与第二原发恶性肿瘤的风险较低(调整后的比值比0.42;P=0.009)128。在一项使用碳离子放疗和IMRT混合技术的NPC病例系列中,2年局部控制率为95%129。
值得注意的是,质子治疗通常与更高的皮肤毒性频率相关,且比光子治疗更容易受到计划不确定性的影响;因此,在进行治疗期间(甚至适应性计划)需要进行仔细的质量保证和重新成像130。
尽管IMPT在剂量学方面具有优势,但这一新技术的广泛应用受到其有限的可获得性和高成本的限制。在未来,IMPT可能会被保留用于特别具有挑战性的癌症(例如,紧邻重要器官的肿瘤,特别是脑干和视器),以及再照射。需要进一步的前瞻性研究来确定IMPT对于哪些患者群体最具成本效益131。
5-2:放疗剂量的减量
由于鼻咽癌对放疗的高敏感性以及高剂量放疗的长期毒性,正在探索基于诱导化疗反应(通过CT、MRI和/或血浆EBV DNA评估)调整放疗剂量的可行性,这在两项正在进行的研究中进行(NCT03668730 和 NCT03908372)。
然而,尚未有已发表的前瞻性成人研究显示,将放疗剂量降低到低于常规使用的70Gy的水平会导致非劣效的结果132。然而,CSCO–ASCO 2021指南建议,对于非常敏感、体积小的原发肿瘤,可以考虑使用较低的总剂量(66–68Gy)108。
IMRT的长期毒性可能会影响幸存者的生活质量,并偶尔会导致生命威胁。根据一项对3,328名接受IMRT治疗的患者的研究,最常见的≥3级(除内分泌障碍外,其中百分比提供的是≥2级)不良事件是内分泌障碍(13.4%的患者),听力障碍(7.1%),颅神经麻痹(5.1%)和颞叶坏死(0.9%)133。
尽管IMRT可以保护腮腺,但临床上有意义的长期口干症仍可能在约25%的患者中发生134,135。尽管理论上担心IMRT与2D和3D适形技术相比,较大的低剂量区域可能会增加第二原发恶性肿瘤的风险,但据报道此类事件的发生率并不高。
事实上,在2D/3D适形时代,其发生率在最长随访期为5.7年的范围内为2.0–5.6%,而根据Zhang等人的研究,IMRT的5年累积发生率为2.6%136,137。然而,另一项研究显示,接受IMRT治疗的6.7%的患者随后发展了第二原发肿瘤,标准化发生比为1.84(95% CI 1.37–2.42),与一般人群相比138。
5-3:自适应放疗计划和人工智能
放疗的质量取决于放疗肿瘤学家的勾画。
近年来,几项国际共识指南帮助标准化了靶区和相邻器官的勾画,以及放疗计划中的剂量优先权和接受标准139–142。患者也可能在放疗期间出现明显的解剖变化,导致剂量学不准确(例如,由于体重减轻,或由于大型淋巴结或腮腺的缩小)143。
因此,可能需要进行自适应计划,即在放疗过程中重新规划,以考虑解剖变化。例如,IMRT和VMAT重新规划与对侧腮腺剂量的降低相关144,并且在重新规划后2年的局部区域控制率(97.2%与无重新规划的92.4%相比;P= 0.040)和预期之外的3年总生存率(88%;95% CI 78–94%)更高146。然而,重新规划非常耗时,人工智能(AI)可能是解决这个问题的一种有前景的解决方案。
在自动勾画中,有两种不同的AI方法经常被使用:深度学习自动分割(通常通过卷积神经网络实现)和基于图谱的自动分割137。AI极大地减少了勾画所需的时间;例如,在一项由Fung等进行的试验中,正常器官勾画的平均时间从108分钟减少到10分钟(P<0.001),尽管目前尚不足以独立使用而不需要人工干预,并且可能导致对重要器官剂量的估算不准确147,148。
相比之下,AI可以帮助减少观察者之间的变异,并提高相邻非恶性组织和靶区勾画的准确性149,150。尽管需要进一步研究AI算法,但未来的前景看起来是光明的。
六、转移性鼻咽癌的管理
6-1:局部区域复发治疗
在IMRT时代,局部区域复发较为罕见;回顾性研究估计局部失败率为5–15%151。手术、再放疗和系统性治疗之间并未在随机对照试验中进行比较;然而,对于初始确定性治疗后局部区域复发或持续疾病患者,应考虑挽救性手术。
挽救性颈部清扫术通常在孤立性区域复发患者中进行,并在一项非比较回顾性研究中与5年OS的40.5%相关152。对于鼻咽部局部复发的患者,可以考虑内镜切除术和开放性鼻咽切除术。在一项涉及第六版AJCC分期rT1–T3疾病患者的病例对照研究中,这种方法与IMRT相比,5年OS更高(77.1%对55.5%;P=0.003),与再放疗相比,毒性发生率更低153,154。
再放疗通常使用IMRT、立体定向体部放疗或IMPT进行,60 Gy(常规分次)被认为是实现最佳局部控制的最低剂量154。再放疗的主要缺点是长期病残或甚至死亡的风险更高155,156。对于各种肿瘤类型(包括NPC)的患者,包括质子治疗和其他重带电粒子在内的回顾性研究报道了经验157–162。
一般来说,无论使用何种放疗方式进行挽救,1–2年内的局部控制率均可达到≥50%。
6-2:局部消融治疗
对于单一转移或寡转移性疾病的患者,可以使用局部治疗方法,如立体定向体部放疗、转移灶切除和射频消融,来消融转移病灶20,163,164,治疗方式的选择取决于多个因素,如病灶的大小、数量和位置164–168。
值得注意的是,寡转移性NPC的定义仍有争议,一些专家将其定义为在两个器官内存在≤3个转移病灶,最大最长直径为5 cm(参考文献169)。几项回顾性研究已报告了使用根治性放疗控制初诊转移性NPC患者局部区域疾病的有希望的结果168,170–172。
在这类疾病设置的III期研究中,对顺铂-5-氟尿嘧啶有完全或部分反应的患者,接受高剂量IMRT(最高70Gy)治疗鼻咽部和颈部后,其生存期更长(HR 0.42, 95% CI 0.23–0.77; P=0.004)而非仅接受化疗的患者173。顺铂-吉西他滨在一线治疗中比顺铂-5-氟尿嘧啶更有效,因此确定是否可以复制这种化疗基础的结果是很有兴趣的101。
6-3:全身治疗
复发/转移性鼻咽癌(R/M NPC)患者的预后异质性,取决于患者是否呈现原发、播散或寡转移性疾病——胸部局限性疾病与最佳预后相关165,166。
铂类化疗仍然是NPC的标准姑息治疗
在过去20年发表的多种药物化疗的II期研究中,中位OS持续时间介于11至28个月之间,中位无进展生存期介于7.3至10个月之间151。
一项具有里程碑意义的III期研究强调了铂-吉西他滨作为R/M NPC一线治疗的标准方案,优于铂-5-氟尿嘧啶,因为在前者中,中位无进展生存期,即主要终点(7.0个月对5.6个月;HR 0.55;P<0.0001)有所改善101。
在涉及973名患者的16项试验的元分析中,比较了四种常用的铂类方案,三联疗法与双联疗法相比,与最高的OS相关(HR 0.74, 95% CI 0.62–0.87),而与吉西他滨或5-氟尿嘧啶的组合相比,含税剂的疗法与略高的1年OS率相关(HR 0.79, 95% CI 0.65–0.92)174。
在铂类耐药性疾病中,由于缺乏公认的标准治疗,许多单臂II期研究探索了针对EGFR或PI3K–AKT信号通路以及表观遗传调节剂的药物。这些药物在铂类耐药NPC中的临床活性令人失望,这可能反映了NPC中可操作性改变的普遍性较低(❤️%)。
鉴于影响细胞周期控制的基因突变(如CDKN2A失活和CCND1扩增)的普遍性和致病作用,以及NF-κB介导的信号及其负调节因子,如CDK4/6和BCL3这样的有前景的靶点值得进一步研究,这些靶点在越来越多新建立的EBV阳性NPC模型中得到验证31。
值得注意的是,9p21区域(包含MTAP和CDKN2A)的纯合缺失是NPC中最常见的基因组改变之一(>40%)27,28。一项I期试验正在测试一种合成致死方法,即MTAP缺失的癌症患者接受MAT2A抑制剂AG-270(NCT03435250)186。如果有效,这种精准的肿瘤学策略应在MTAP缺失的NPC患者中进行未来的临床评估。
尽管NPC中存在表观遗传改变,但表观遗传调节剂的临床开发仍处于概念阶段。
CpG甲基化涉及EBV相关基因的表观遗传沉默;阿扎胞苷可以诱导EBV启动子中的CpG位点的显著去甲基化,这些启动子来自NPC患者的原发肿瘤活检样本184。另一种正在研究的途径涉及PRC2/EED-EZH2复合体的成分,如EZH2和EED187。在体外模型中,抑制EED改变了HLA和细胞周期相关基因的表达187;因此,应进一步研究EZH2或EED抑制剂与CDK4/6抑制剂或免疫检查点抑制剂的组合策略。
在经过大量预治疗的NPC患者中,已测试了VEGF-VEGFR信号通路的抑制剂,总体反应率(ORRs)介于2.7%至31.3%之间179–182,188。这些药物应避免用于侵犯大血管的局部区域复发NPC患者,因为可能存在致命性出血的风险181。
在NPC患者中,同时接受VEGF-VEGFR抑制剂和化疗的肿瘤活检样本中观察到了增强的免疫细胞浸润,因此,涉及VEGFR抑制剂和免疫检查点抑制剂的组合策略目前正在临床评估中。例如,目前正在进行AXEL II期试验(NCT04562441),评估axitinib加avelumab在至少接受过一线铂类化疗的R/M NPC患者中的临床活性。
七、免疫治疗
7-1:鼻咽癌的免疫景观
EBV相关的鼻咽癌是一种典型的“免疫热”肿瘤,其基质被免疫细胞密集浸润。
理解鼻咽癌中免疫逃避的关键在于EBV在鼻咽癌细胞中以II型潜伏状态存在,从而表达有限的一组非编码RNA和免疫原性差的与EBV相关的癌蛋白,这些蛋白可以逃避宿主免疫监视190。
全外显子测序和单细胞测序研究的数据逐渐揭示了鼻咽癌的免疫景观,显示了一个被功能失调和耗尽的CD8+ T细胞和效应T(Teff)细胞浸润的抑制性肿瘤微环境,这些细胞过度表达抑制性免疫检查点,如PD-L1、LAG3、galectin 9-TIM3、TIGIT和CTLA418,28,29,32,191,192。
其他免疫抑制细胞,如调节性T细胞、M2型巨噬细胞和髓源性抑制细胞,以及各种趋化因子和细胞因子,都为免疫抑制的肿瘤微环境做出了贡献。
一项对微分离的鼻咽癌样本进行的全外显子测序研究发现,肿瘤的突变率估计超过每肿瘤50个突变,与头颈部鳞状细胞癌和EBV阳性胃癌的肿瘤突变负担相似28。
除了过表达的病毒BNLF2a外,一些在NPC中更常见的体细胞突变可能直接调节NPC的免疫景观,通过干扰抗原呈递(例如,HLA的突变),通过潜伏的EBV介导的持续激活影响Teff细胞的招募,或通过破坏其负调节因子18。
这些免疫和基因组景观的特征为开发NPC患者的免疫治疗提供了肥沃的土壤。
7-2:免疫治疗的演变
鼻咽癌患者的免疫治疗可以大致分为针对EBV的和针对非EBV的策略。
针对EBV的免疫治疗包括EBV特异性疫苗或自体细胞毒性T淋巴细胞(CTLs)的适应性转移、异体CTLs选择性针对EBV相关肿瘤相关抗原(tabelecleucel(NCT03769467))、或用CD137L激动剂诱导的自体树突细胞,并使用EBV肽脉冲(CD137L-DC-EBV-VAX193)。
非EBV靶向的系统性治疗包括针对免疫检查点的单克隆或多特异性抗体、抗体药物偶联物194,以及基因工程细胞疗法,如嵌合抗原受体T细胞疗法、CRISPR–Cas9介导的PD-1敲除T细胞195、细胞因子诱导的杀伤细胞疗法196和扩增激活的自体自然杀伤细胞(NCT02507154)。
在作者撰写这篇综述时,近50项活跃或正在招募的临床试验正在测试这些方法。这些研究中的大多数集中在将抗PD-1或抗PD-L1抗体与放疗或化疗相结合的II期研究中。作者注意到,有超过10项正在进行中的III期研究正在比较标准细胞毒性疗法与或不与抗PD-1或抗PD-L1抗体相结合,在治愈和姑息治疗环境中的疗效(补充表5)。
早期的免疫治疗试验主要集中在治疗性EBV疫苗,针对EBNA1和/或LMP-1/2,或之前在体外激活和扩增的自体CTLs的转移197–206。这些早期的免疫治疗试验具有探索性质,仅在少数晚期NPC患者中观察到客观肿瘤反应。
自体EBV特异性CTL疗法是唯一达到III期评估的策略,在VANCE试验(NCT02578641)中进行了评估。该试验比较了铂-吉西他滨与或不与同期自体EBV特异性CTLs作为R/M NPC患者的一线治疗,结果尚未公布。
目前,最活跃的临床研究集中在抗PD-1或抗PD-L1抗体上。
到目前为止,共有:
- 六种抗PD-1抗体(派姆博利单抗208、纳武单抗209、托里帕利单抗210、卡瑞利珠单抗211、替西利珠单抗212和辛西单抗(NCT03700476))
- 两种抗PD-L1抗体(阿特珠单抗213和杜瓦卢单抗(NCT04447612))
- 两种针对PD-1和CTLA4的双特异性抗体(XmAb20717(NCT03517488)和AK104(NCT04220307))
- 一种针对PD-1和LAG3的双特异性抗体(XmAb22841(NCT03849469))
- 一种双功能融合蛋白(Bintrafusp alfa(NCT04396886),包含与TGFβ受体II型可溶性细胞外域结合的抗PD-1抗体)正在或已在晚期NPC患者中进行评估。
这些研究中大多数报告的是抗PD-1或抗PD-L1单药治疗的单臂II期试验(补充表6)15,208–214。这些试验的结果被汇总在一个元分析中,该分析报告了接受抗PD-1抗体治疗的患者的客观反应率(ORR)为27%,1年无进展生存率(PFS)为25%,1年总生存率(OS)为61%215。
在这些研究中,大多数患者是根据PD-L1表达状态选择的;值得注意的是,在NCI-9742 II期研究中,18名PD-L1阳性肿瘤患者中有6名(33%)对nivolumab有反应,而23名PD-L1阴性肿瘤患者中只有3名(13%)有反应(非统计学显著趋势)209。
两项随机多中心研究比较了抗PD-1抗体与医生选择的化疗在铂类耐药R/M NPC的后续治疗线中的疗效。随机II期研究Spartalizumab未能达到其PFS的主要终点216,而III期KEYNOTE122试验已完成入组,结果尚未公布(NCT02611960)。
与其他实体瘤一致217,NPC中抗PD-1或抗PD-L1抗体的临床开发可以分为两大类:将这些免疫检查点抑制剂与细胞毒性治疗(化疗或放疗)结合,或与针对其他免疫检查点(如CTLA4、IDO或LAG3)的药物结合。
在姑息治疗环境中,几项值得注意的III期研究比较了铂-吉西他滨与或不与同期抗PD-1抗体在R/M NPC的一线治疗中的疗效,可能会有改变实践的结果:这些研究中包括一项安慰剂对照的试验。
总的来说,免疫治疗在鼻咽癌中的应用正迅速发展,随着更多的临床试验数据的公布,对于NPC患者的治疗选择将更加丰富和精准。
同时,免疫治疗与其他治疗方法的结合可能为NPC患者提供更好的治疗效果。然而,仍需进一步的研究来确定最佳的免疫治疗策略,以及这些策略在不同亚型NPC患者中的疗效和安全性。
八、个性化治疗的生物标志物
8-1:血浆EBV DNA
血浆EBV DNA作为EBV相关NPC的典型液体活检,得益于特定实时定量PCR检测方法的发展43。
关于血浆EBV DNA作为NPC生物标志物的开发历程,已有大量文献进行了详细回顾219,220。在本综述中,作者关注的是在五个关键领域扩大其应用时面临的最相关挑战:
- 筛查
- 治疗前分期和风险分层
- 指导诱导或辅助化疗的个性化
- 治疗后复发监测
- 评估姑息系统性治疗的反应
血浆EBV DNA的大量文献中最引人注目的观察之一是,在治愈性放疗的不同时间点,定义临床有意义的血浆EBV DNA水平的阈值存在显著的变异性。
此外,一项包含27,235名患者的元分析显示,几乎所有报道的EBV DNA阈值(拷贝/ml)在放疗前或后都与生存结果有统计学相关性,尽管相关程度不同221。
三项前瞻性研究探讨了将血浆EBV DNA作为TNM分期标准或治疗后预后预测中的分层因素,这些研究采用了截然不同的血浆EBV DNA阳性的定义阈值,以及不同的测试时间点和间隔222–224。
例如,作者的团队结合了放疗后血浆EBV DNA和TNM分期(根据AJCC第七版分类的II–IVB期),并通过递归分区分析将患者分为三个组,这三个组的预后价值优于TNM分期或放疗后EBV DNA单独222。因此,国际社会需要努力就评估血浆EBV DNA的标准达成共识,并制定国际实践指南。
血浆EBV DNA在指导局部区域晚期NPC患者选择辅助和诱导化疗方面的作用是一个活跃的研究领域。例如,NRG-HN001研究(NCT02135042)正在探讨这个问题,该研究通过随机分配检测到血浆EBV DNA的患者,分别接受顺铂-5-氟尿嘧啶或吉西他滨-紫杉醇的三或四周期治疗,未检测到血浆EBV DNA的患者则随机分配接受顺铂-5-氟尿嘧啶或观察225。
一些研究者采用了一种适应性方法,利用EBV DNA指导诱导化疗。
例如,Lv等人在一组统一治疗的患者中使用治疗期间EBV DNA监测,并发现患者之间的病毒拷贝数清除存在显著的个体间异质性,并根据血浆EBV DNA清除定义了四种主要的反应表型226。这些表型(被称为早期反应者、中间反应者、晚期反应者和治疗抵抗型)与无病生存终点密切相关,因此,其使用可以为个体患者实时调整治疗铺平道路226。
这一概念正在一项观察性队列研究(NCT03855020)和多中心随机EP-STAR研究中前瞻性测试(NCT04072107),其中被认为处于中间反应状态的患者将随机分配接受辅助的甲氨蝶呤或免疫检查点抑制剂辛西单抗。
8-2:其他生物标志物
PD-L1作为NPC的生物标志物使用受限,主要由于缺乏定义临床有意义阈值、选择检测方法和最佳分析方法的一致性227–232。
一项元分析未显示PD-L1表达与NPC的总生存率(OS)之间存在统计学显著相关性231。考虑到其他癌症中联合阳性评分和肿瘤比例评分的临床实用性,使用22C3的免疫组织化学染色对98例原发性NPC样本进行了试点研究。
结果显示,具有≥1%、≥10%和≥50%联合阳性评分的肿瘤百分比分别为91.8%、46.9%和21.4%,而具有≥1%、≥10%和≥50%肿瘤比例评分的肿瘤百分比分别为55.1%、29.6%和13.2%(K.-W.L., 未发表的数据)。尽管NCI-9721研究中的nivolumab数据显示,肿瘤表达PD-L1(>1%)的患者可能具有更高的客观反应率(ORR)的趋势209,233,但PD-L1表达在指导NPC治疗中的预测作用仍需定义。
预测性生物标志物,如微卫星不稳定性、肿瘤突变负担和可操作的热点突变,在NPC中非常罕见:<2%的NPC具有微卫星不稳定性表型,只有1.1%的未分化NPC具有>10个突变/Mb的肿瘤突变负担234。在一项小规模队列研究中,接受抗PD-1或抗PD-L1抗体的携带PDL1基因扩增的实体瘤患者的ORR为66.7%;然而,只有5.1%的NPC患者具有这种遗传变异234。
基于微RNA、DNA甲基化、mRNA基因表达、免疫检查点和环状RNA的遗传特征在NPC中都有预后意义235–239,但这些特征的临床实用性仍需定义,目前只有少数特征在独立的临床队列中得到了验证。
值得注意的是,两个不同的微RNA特征使能够根据大训练集和内部验证集的患者样本计算与生存相关的风险评分235和远处转移235,240。然而,这些发现在大规模多中心前瞻性研究中的验证对于确认其在NPC患者临床管理中的效用至关重要。
同样,新的成像标志物的临床应用仍需定义,尽管有几个有希望的标志物可以在治疗开始前或早期根据扫描预测反应。这些标志物包括18F-FDG-PET241,242、扩散加权成像的功能MRI标志物243–245、动态对比增强MRI246和酰胺质子转移成像247以及新的淋巴结体积和额外结外扩展的形态学标准114,248。
九、结论
尽管在过去二十年里,NPC的治疗技术取得了进步,治疗方法也迅速发展,但大多数患者仍呈现局部区域晚期疾病;因此,在流行地区实施筛查计划应成为优先事项。近年来,包括ASCO、ESMO和CSCO在内的几个学术团体已发布了临床实践指南108,249。
化疗仍是局部区域晚期NPC治疗的重要组成部分,尤其是在与放疗联合使用时。铂-吉西他滨已确立为R/M NPC一线治疗的首选化疗方案。在一线姑息化疗且无进展的初诊转移性疾病的患者中,局部区域放疗可能会提高OS,并可能成为新的标准治疗。
全外显子测序研究表明,NPC中可操作性改变的普遍性较低,但有助于阐明NPC的基因组景观,揭示了几个潜在的新靶点,如CDK4/6、BCL3和MAT2A。NPC是一种“免疫热”肿瘤,单用抗PD-1或抗PD-L1抗体与铂类耐药疾病中的持久反应相关。在局部区域晚期和R/M NPC的环境中,抗PD1或抗PD-L1抗体在组合疗法中的使用目前是一个研究热点。
许多生物标志物已被发现对NPC具有预后意义,但它们在指导治疗中的作用仍需定义。血浆EBV DNA仍然是NPC中最具有临床价值的生物标志物,多个正在进行的研究正在评估其在指导治疗中的作用。随着NPC研究步伐的加快,通过许多范式改变性的突破,患者和将他们的护理托付给医疗保健提供者和临床试验调查员的临床试验参与者们的希望终将实现。