小罗碎碎念
本期推文主题:人工智能在子宫内膜癌领域中的研究进展
昨天的推文主要介绍的是卵巢癌,有一小部分涉及到了子宫内膜癌,按照最新的规划,今天的推文是与子宫内膜癌相关的。
从事妇科肿瘤研究的老师/同学,可以好好看看第二篇文献,华西2023年出品的一篇综述,发表于《Semin Cancer Biol》,目前IF=12.1。
今天的文章主要涉及的是病理组学、蛋白组学和基因组学,影像组学涉及的相对较少,大家自行选取适合自己的文献。

一、基于AI的组织病理学图像分析区分子宫内膜癌亚群

一作&通讯
| 角色 | 姓名 | 单位名称(中文) | 单位名称(英文) |
|---|---|---|---|
| 第一作者 | Amirali Darbandsari | 不列颠哥伦比亚大学电子与计算机工程系 | Department of Electrical and Computer Engineering, University of British Columbia |
| 第一作者(共同) | Hossein Farahani | 不列颠哥伦比亚大学生物医学工程系 | School of Biomedical Engineering, University of British Columbia |
| 第一作者(共同) | Maryam Asadi | 不列颠哥伦比亚大学生物医学工程系 | School of Biomedical Engineering, University of British Columbia |
| 通讯作者 | Ali Bashashati | 不列颠哥伦比亚大学生物医学工程系 | School of Biomedical Engineering, University of British Columbia |
| 通讯作者(共同) | David G. Huntsman | 不列颠哥伦比亚大学病理学与实验医学系 | Department of Pathology and Laboratory Medicine, University of British Columbia |
| 通讯作者(共同) | Naveena Singh | 不列颠哥伦比亚大学病理学与实验医学系 | Department of Pathology and Laboratory Medicine, University of British Columbia |
| 通讯作者(共同) | Jessica N. McAlpine | 不列颠哥伦比亚大学妇产科 | Department of Obstetrics and Gynaecology, University of British Columbia |
文献概述
这篇文章通过应用人工智能技术对组织病理学图像进行分析,揭示了子宫内膜癌(EC)中具有不同预后的特定亚群,并可能有助于改善临床治疗决策。
研究团队利用AI技术区分了p53异常(p53abn)和无特定分子特征(NSMP)的EC亚型,并识别出一个具有明显较差无病生存和疾病特异性生存的NSMP EC患者亚群(称为“p53abn-like NSMP”)。这项研究在发现队列中的368名患者以及来自其他中心的两个独立验证队列中的290和614名患者上进行。
研究表明,AI在检测预后不同且传统和标准分子或病理标准无法识别的EC亚群方面具有强大的能力,从而改进了基于图像的肿瘤分类。这项工作还通过浅层全基因组测序揭示了“p53abn-like NSMP”组与NSMP相比具有更高的拷贝数异常负担,表明这一组在生物学上与其他NSMP EC不同。
研究还发现,即使在考虑了等级、阶段和组织学等其他临床和病理参数后,通过AI模型识别的p53abn-like NSMP肿瘤在多变量Cox回归分析中与较差的无进展生存期独立相关。此外,通过独立病理学复查和目标基因测序,研究团队进一步证实了AI模型识别出的肿瘤在组织学和分子水平上具有独特性。
这项研究的结果不仅对女性子宫内膜癌的诊断和治疗具有潜在的重要意义,而且展示了AI在医学图像分析中的实用性和前景。研究强调了AI技术在提高疾病预后评估准确性和指导个性化治疗方面的潜力。
重点关注
图1展示了基于AI的组织病理学图像分析的工作流程
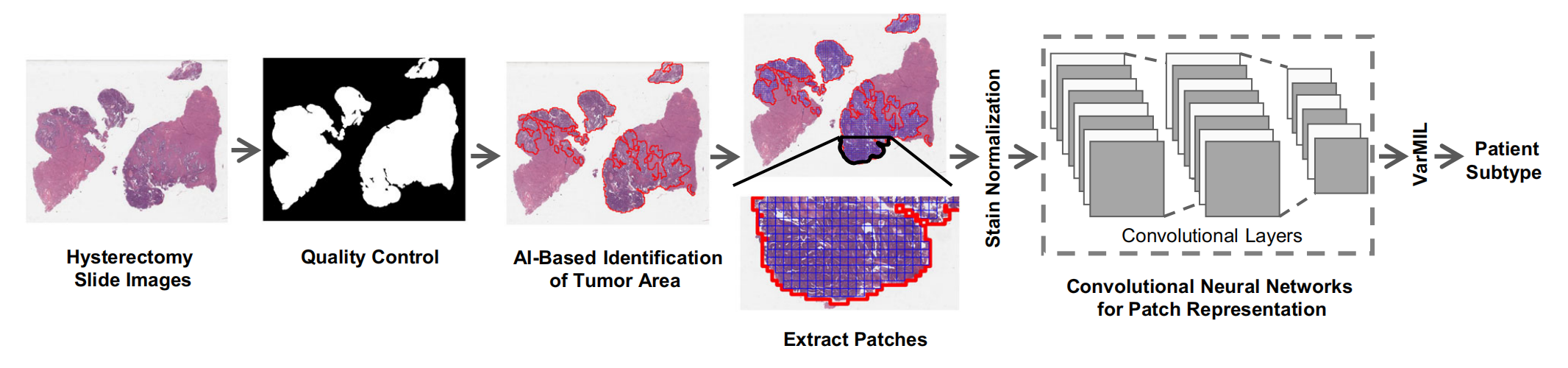
- 质量控制:首先使用HistoQC81这一质量控制框架来生成一个仅包含组织区域的掩膜,并去除图像中的伪影和杂质。
- 肿瘤区域识别:接着,训练一个AI模型来识别组织病理学幻灯片中的肿瘤区域。
- 图像分割与标准化:将图像分割成小的块(patches),并对这些块进行标准化处理,以消除不同染色过程引起的颜色变化。
- 深度学习特征提取:将标准化后的图像块输入到深度学习模型中,以获得每个图像块的特征表示。
- 患者亚型预测:最后,使用基于多重实例学习(VarMIL)的模型,根据提取的图像块特征来预测患者的亚型。
整个流程是一个从原始的组织病理学图像到最终患者亚型预测的自动化过程,涉及到图像预处理、特征提取和模式识别等多个环节,充分展示了AI在医疗图像分析领域的应用潜力。
二、人工智能在妇科肿瘤学中的精准医疗应用与挑战

一作&通讯
| 角色 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | 江宇婷 | 四川大学华西第二医院/教育部妇儿先天缺陷与相关疾病重点实验室,四川省,中国 |
| 通讯作者 | 周胜涛 | 四川大学华西第二医院/教育部妇儿先天缺陷与相关疾病重点实验室,四川省,中国 |
文献概述
这篇文章综述了人工智能在妇科肿瘤学中的应用,特别是在风险分层、准确诊断和治疗预测方面的进步和挑战。
-
引言:介绍了AI如何为精准肿瘤学铺平了道路,并强调了AI在肺癌、乳腺癌和脑肿瘤等领域的成功应用,同时也指出了在妇科肿瘤学研究中的关注度相对较低。
-
AI工具和技术:讨论了AI的基本概念,包括机器学习和深度学习,以及它们在监督学习、半监督学习、无监督学习和强化学习中的应用。
-
早期检测:探讨了AI在妇科肿瘤早期检测中的应用,包括宫颈、卵巢和子宫内膜癌的筛查,以及使用视觉检查、医学影像和血清标志物等数据流。
-
癌症诊断、分期和分级:分析了AI在提高妇科肿瘤诊断准确性和肿瘤亚型分层中的作用,包括使用癌症影像和非图像数据(如分子分析数据)。
-
治疗反应预测和预后:讨论了AI在预测患者预后和推荐治疗方面的应用,包括风险分层、手术前评估、化疗反应预测和其他治疗方法的候选者识别。
-
当前挑战和未来展望:描述了将AI模型应用于现实世界中所面临的挑战,包括数据质量和多样性、偏见、解释性和不确定性问题。
-
结论:总结了AI在妇科癌症护理中的潜力和未来应用,同时强调了需要解决的主要伦理和技术问题。
文章强调了AI技术在提高妇科肿瘤学诊断、治疗和患者护理质量方面的潜力,同时也指出了实现这一目标所需克服的挑战。
重点关注
图 2 展示了用于医学成像的卷积神经网络(CNN)的通用框架。
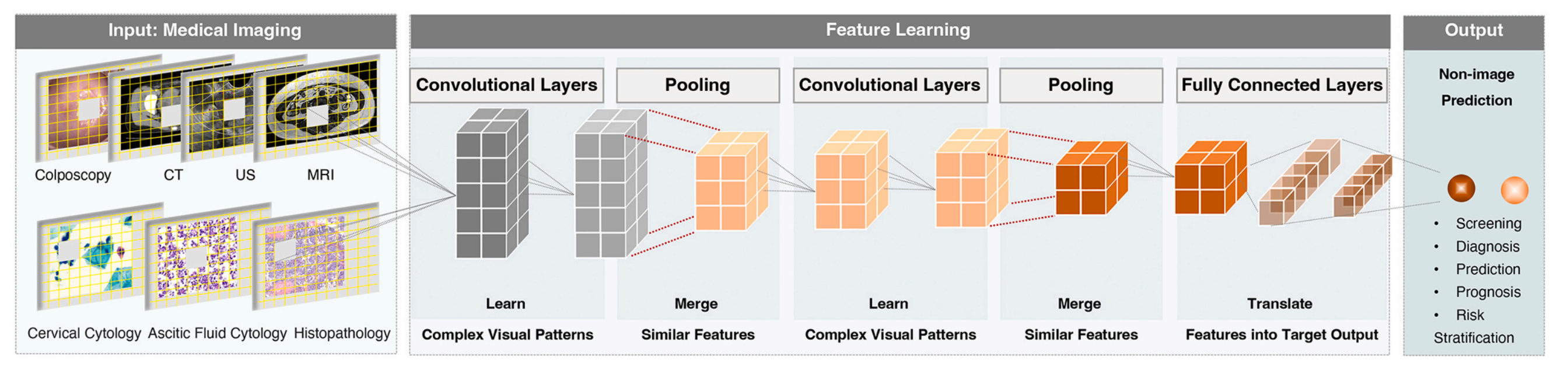
这个框架描述了一个大规模的多层卷积神经网络如何处理各种医学数据,包括阴道镜图像、放射图像、细胞学图像和组织病理学图像。
CNN 通过以下几个步骤顺序地转换输入图像:
-
卷积层(Convolutional Layer):这是网络的第一层,负责提取图像中的局部特征。通过一系列的过滤器(或称为卷积核)在图像上滑动,以识别图像中的模式和边缘等特征。
-
池化层(Pooling Layer):通常跟在卷积层之后,用于降低特征的空间维度,从而减少参数的数量和计算的复杂性,同时使特征检测更加鲁棒。
-
全连接层(Fully Connected Layer):在网络的末端,用于整合从前面层级提取的特征,进行最终的分类或回归任务。
这些层级将输入图像转换成一系列平展的输出向量,这些向量可以用于进一步的处理,比如模式识别或分类。CT(计算机断层扫描)、US(超声波成像)、MRI(磁共振成像)是医学成像技术的例子,它们提供了不同类型的医学图像数据供 CNN 分析。
总的来说,图 2 描述了 CNN 如何通过不同层级的处理,从原始医学图像中提取特征并进行分析,以实现对疾病状态的诊断和分类。
三、NaroNet:一种深度学习框架,用于从多重染色图像中发现肿瘤微环境元素

一作&通讯
| 角色 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Daniel Jiménez-Sánchez | 纳瓦拉大学,应用医学研究中心,西班牙纳瓦拉 |
| 通讯作者 | Carlos Ortiz-de-Solórzano | 纳瓦拉大学,应用医学研究中心,西班牙纳瓦拉 |
文献概述
这篇文章介绍了一种名为NaroNet的深度学习框架,它能够从高度多重染色的癌症组织图像中发现肿瘤微环境(TME)的元素,并且提供患者层面的可解释预测。
NaroNet通过端到端的学习流程,仅使用多重染色组织图像及其对应的患者临床标签进行训练,能够无监督地学习哪些细胞表型、细胞邻域以及邻域间的互动对于预测正确的标签具有最高的影响力。
NaroNet结合了多种新颖和最先进的深度学习技术,包括局部对比学习、多级图嵌入、一种新颖的最大和池化操作,以及量化每个微环境元素在个体预测中相关性的度量标准。研究者们首先使用模拟数据来验证NaroNet,然后将其应用于两组人类癌症组织的图像数据集:一组来自12位高级别子宫内膜癌患者的336张7色多重染色图像,以及一组来自215位乳腺癌患者的382张35重质谱细胞图像。在合成数据和真实数据中,NaroNet都能提供出色的临床信息预测,并且能够将这些预测与特定微环境元素的存在联系起来。
此外,文章还讨论了NaroNet在计算病理学领域的两个主要策略:弱监督深度学习(WSDL)和单细胞分析(SCA)。NaroNet旨在结合这两种策略,自动化地在原位发现对特定临床预测任务相关的肿瘤微环境元素。通过这种方法,NaroNet不仅能够提供高度可解释的预测结果,而且能够发现新的与疾病相关的生物标志物,为临床病理学和癌症治疗提供新的见解和工具。
重点关注
Fig. 1展示了NaroNet学习与发现协议的流程图,具体步骤如下:
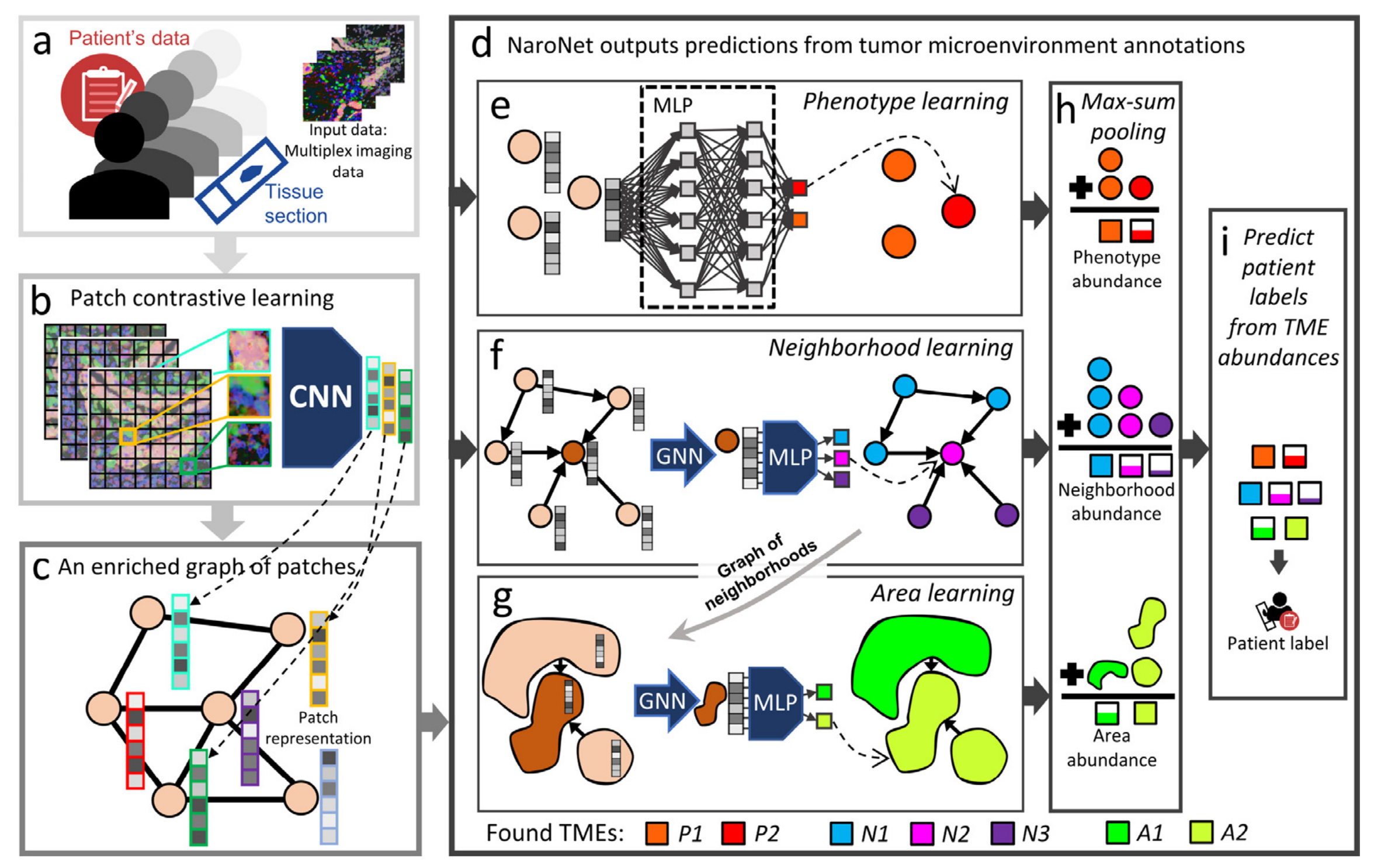
a. 输入数据:由多重染色的癌症组织图像组成,包含相关的临床和病理信息。
b. 局部对比学习模块(Patch Contrastive Learning, PCL):此模块将图像分割成小块(patches),并使用一个无监督训练的卷积神经网络(CNN),将每个图像块嵌入到一个256维的向量空间中。这个CNN被训练为将包含相似生物结构的图像块分配相似的向量。
c. 富集图生成:创建了一个包含组织块之间空间交互的富集图,这个图捕获了图像块之间的邻近关系。
d. NaroNet模型:这个图被送入NaroNet,一个可解释的神经网络集成,它学习表型(e)、表型邻域(f)以及邻域间的交互区域(g),以根据肿瘤微环境元素的丰度(h)对患者进行分类(i)。图例中解释了CNN(卷积神经网络)、MLP(多层感知器)、GNN(图神经网络)的含义。
总的来说,Fig. 1描述了NaroNet如何通过一系列深度学习技术从多重染色的癌症组织图像中提取特征,并利用这些特征来理解肿瘤微环境的空间相互作用,进而对患者进行分类。这个过程强调了从图像分割到特征提取,再到图结构的构建,最后通过深度学习模型进行模式识别和分类的端到端方法。
四、多模态深度学习模型HECTOR:精准预测子宫内膜癌复发风险

一作&通讯
| 角色 | 作者名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Sarah Volinsky-Fremond | 荷兰莱顿大学医学中心病理学系 |
| 通讯作者1 | Tjalling Bosse | 荷兰莱顿大学医学中心放射肿瘤学系和病理学系 |
| 通讯作者2 | Viktor H. Koelzer | 瑞士苏黎世大学医院病理学和分子病理学系 |
文献概述
这篇文章报道了一种新型多模态深度学习模型HECTOR的开发,该模型能够通过分析子宫内膜癌患者的全切片图像和肿瘤分期来预测远处复发风险,并在准确性上超越了现有的预测方法。
研究团队开发了一个名为HECTOR(histopathology-based endometrial cancer tailored outcome risk)的多模态深度学习预测模型,旨在预测子宫内膜癌(EC)的复发风险。该模型使用苏木精-伊红染色的全切片图像(WSI)和肿瘤分期作为输入,对来自八个EC队列的2,072名患者进行了训练和测试,包括PORTEC-1/-2/-3随机试验。
HECTOR模型在内部测试集(353名患者)和两个外部测试集(分别为160名和151名患者)上展示了出色的预测准确性,C指数分别为0.789、0.828和0.815,超过了当前的金标准。HECTOR还通过Kaplan-Meier分析识别了具有显著不同预后的患者群体,10年远处无复发概率分别为97.0%、77.7%和58.1%,对应于HECTOR低风险、中风险和高风险组。
此外,HECTOR在预测辅助化疗效果方面也优于现有方法。形态学和基因组特征提取揭示了HECTOR风险组的相关性,其中一些具有治疗潜力。研究表明HECTOR在提高当前金标准方面具有潜力,并可能有助于EC个性化治疗的实施。
研究还探讨了HECTOR模型的设计和性能,包括自监督学习、多模态三臂架构以及对远处无复发概率的预测。HECTOR模型的最终架构包括对H&E染色的WSI、基于图像的分子类别以及外科手术评估的解剖学分期的融合。
文章还讨论了HECTOR模型与当前预测EC预后的金标准相比的优势,包括成本效益、实施的便捷性以及在预测远处复发风险和辅助化疗效果方面的能力。研究结果表明,HECTOR模型有望成为一个有效的工具,用于个性化预测EC患者的预后,并可能帮助指导临床治疗决策。
重点关注
图4展示了对HECTOR风险评分有贡献的形态学特征。
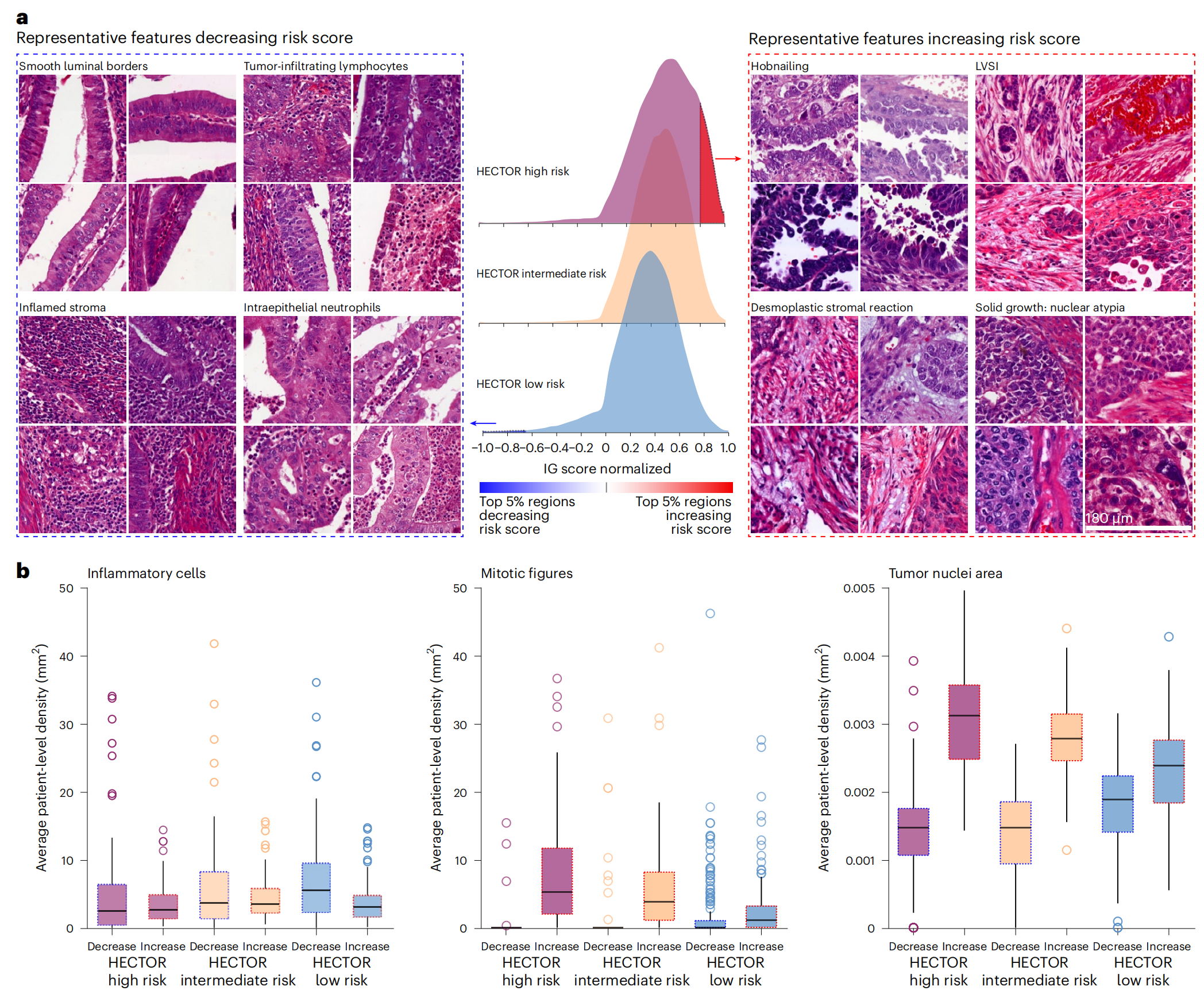
该图分为两个部分:
a部分:
- 使用IG方法(Integrated Gradient方法)识别了对风险评分影响最大的前5%区域,这些区域是从HECTOR高风险和低风险组中提取出来的,用于定性和定量分析。
- 为每种形态学亚型(每个亚型从不同患者中选取)选出了四个代表性的图像块(patches),这些图像块显示了HECTOR高风险组(右侧)风险评分的增加,以及HECTOR低风险组(左侧)风险评分的减少。
- 每个图像块的尺寸为180微米×180微米。
b部分:
- 在这些风险评分增加或减少的前5%区域中,使用基于深度学习(DL-based)的图像分析工具检测并计算了炎性细胞、有丝分裂图像和肿瘤核面积。
- 报告了内部测试集(n=353)中每位患者的平均值。
- 箱线图(box plots)中的中心刻度表示中位数值,箱子的下半部分和上半部分分别表示第一四分位数(Q1)和第三四分位数(Q3)。
- 胡须(whiskers)的界限定义为(Q1 - 1.5×四分位距IQR,Q3 + 1.5×IQR)。任何超出胡须范围的异常点都用点标记显示。
这部分研究结果表明,HECTOR模型能够识别出影响风险评分的关键形态学特征,并通过定量分析这些特征在不同风险评分组中的分布差异。通过这些分析,研究者可以更好地理解模型预测背后的生物学机制,并可能为临床决策提供支持。
五、年龄作为子宫内膜癌独立因果风险因素的研究

一作&通讯
| 角色 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Famke C Wakkerman | 荷兰莱顿大学医学中心 |
| 通讯作者 | Nanda Horeweg | 荷兰莱顿大学医学中心放疗科 |
文献概述
这篇文章通过多方法分析发现,老年女性患子宫内膜癌的复发和癌症相关死亡风险更高,且年龄是一个独立的因果风险因素。
研究使用了三个大型随机试验(PORTEC-1、PORTEC-2和PORTEC-3)的数据集,共纳入了1801名女性的统计分析和因果推断。研究发现,年龄较大的女性患者更有可能表现出更具侵袭性的肿瘤特征,并且与更差的肿瘤学结果独立且因果相关。研究结果表明,老年女性不应仅基于年龄就被排除在诊断评估、分子检测和辅助治疗之外。
研究背景是,尽管已有研究表明老年女性患子宫内膜癌的复发风险和癌症相关死亡风险更高,但尚不清楚年龄较大的是否是一个因果预后因素,或者是否只是其他风险因素随年龄增长而越来越普遍。
研究方法包括使用非参数测试分析年龄与临床病理学和分子特征的关联,执行多变量竞争风险分析以确定年龄的独立预后价值,并使用名为AutoCI的深度学习因果推断模型来分析年龄作为因果预后变量。
研究发现,随着年龄的增长,总体复发和子宫内膜癌特异性死亡的风险显著增加。老年女性更常见深肌层浸润、浆液性肿瘤组织学和p53异常肿瘤。年龄是总体复发(风险比[HR]每年1.02,95% CI 1.01–1.04;p=0.0012)和子宫内膜癌特异性死亡(HR每年1.03,1.01–1.05;p=0.0012)的独立风险因素,并被确定为显著的因果变量。
研究的解释是,这项研究表明,年龄较大的女性与更具有侵略性的肿瘤特征相关联,并且独立地和因果地与更差的肿瘤学结果相关。因此,研究结果表明,老年女性不应仅因为年龄就被排除在诊断评估、分子检测和辅助治疗之外。
重点关注
Figure 1 展示了按年龄组划分的总体复发率和子宫内膜癌特异性死亡率的累积发生率。
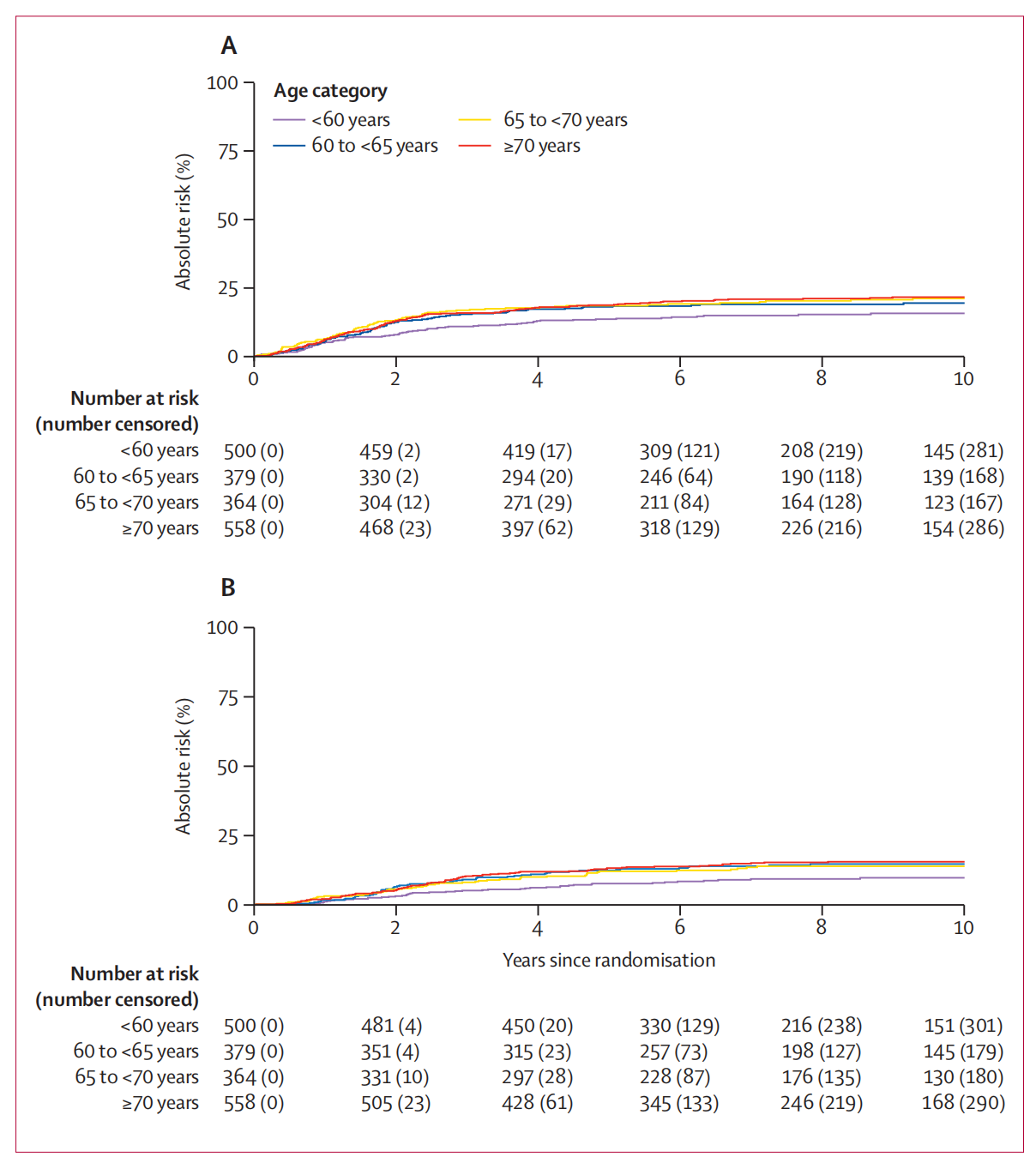
(A) 总体复发的累积发生率按年龄组:
- 该图可能显示了不同年龄组(例如:<60岁、60-69岁、≥70岁)的患者在研究期间累积复发率的变化。
- 通常,曲线会随着时间的推移而上升,反映出随着时间的推移,患者复发的累积风险增加。
- 曲线的斜率可能表明,年龄较大的组别(例如:≥70岁)的复发率上升速度更快,表明老年患者的复发风险更高。
(B) 子宫内膜癌特异性死亡的累积发生率按年龄组:
- 类似于总体复发的分析,这个图表也可能展示了不同年龄组患者的子宫内膜癌特异性死亡率随时间的变化。
- 累积发生率曲线可能揭示了年龄较大的患者组(如≥70岁)在研究期间具有更高的子宫内膜癌特异性死亡率。
- 曲线的形状和斜率可能表明,尽管所有年龄组的累积死亡率都会随着时间增加,但老年组的增加更为显著,这与年龄相关的生物学和临床因素有关。
在两个图表中,累积发生率曲线的上升可能反映了老年女性在治疗后面临更高的复发和死亡风险。这些数据强调了在制定治疗计划时需要考虑患者年龄的重要性,并可能提示老年患者需要更密切的监测和可能的个性化治疗策略。
六、子宫内膜癌的蛋白质组学研究为精准医疗提供新视角

一作&通讯
| 作者类型 | 姓名 | 单位名称(中文翻译) |
|---|---|---|
| 第一作者 | Yongchao Dou | Baylor College of Medicine, Houston, TX 77030, USA 贝勒医学院,休斯顿,德克萨斯州 77030,美国 |
| 通讯作者 | M.L.A. | University of South Florida Morsani College of Medicine and Tampa General Hospital Cancer Institute, Tampa, FL 33606, USA 南佛罗里达大学莫尔萨尼医学院和坦帕总医院癌症研究所,坦帕,佛罗里达州 33606,美国 |
| 通讯作者 | K.D.R. | Oregon Health & Science University, Portland, OR 97221, USA 俄勒冈健康与科学大学,波特兰,俄勒冈州 97221,美国 |
| 通讯作者 | B.Z. | Baylor College of Medicine, Houston, TX 77030, USA 贝勒医学院,休斯顿,德克萨斯州 77030,美国 |
| 通讯作者 | T.L. | Pacific Northwest National Laboratory, Richland, WA 99354, USA 太平洋西北国家实验室,里奇兰,华盛顿州 99354,美国 |
文献概述
这篇文章通过对子宫内膜癌的蛋白质组学分析,发现了潜在的药物作用途径和生物标记物,有助于实现更精准的治疗。
研究团队利用10种不同的组学平台,对138个子宫内膜癌(EC)肿瘤样本和20个正常子宫内膜组织样本进行了全面的蛋白质组学分析。研究发现了可能的分子和成像标记,用于指导更精确的EC治疗。
主要发现包括:
- 通过靶向蛋白质组学检测可以准确预测抗原处理和呈递机制(APM)的状态,可能有助于免疫治疗的患者选择。
- MYC活性与二甲双胍治疗在患者和细胞系中的关联分析表明,二甲双胍可能对非糖尿病、MYC活性高的EC患者具有治疗作用。
- PIK3R1基因的移码插入缺失与AKT1磷酸化上调相关,可能增加对AKT抑制剂的敏感性。
- CTNNB1基因的热点突变阻止了pS45诱导的β-catenin降解,可能使Wnt-FZD拮抗剂无效。
- 深度学习能够从组织病理学图像中准确预测EC亚型和突变,可能有助于快速诊断。
研究还探讨了EC的发病率和死亡率,以及不同种族和族裔之间的差异。通过综合基因组分析,研究揭示了EC的关键基因组驱动因素,并定义了四种基于基因组特征的EC亚型:
- POLE超突变型
- 微卫星不稳定性高突变型(MSI-H)
- 拷贝数低(CNV-L)
- 拷贝数高(CNV-H)
研究结果为开发新的治疗策略提供了分子靶标,并可能改善患者的治疗选择和临床结果。