期刊:Nature microbiology
影响因子:30.964
发表时间:2022
样本类型:粪便样本
研究背景
坏死性小肠结肠炎(NEC)是早产的严重后果,通常与肠道细菌微生物群的改变有关。然而,关于早产儿肠道病毒组的发展或其在NEC中的作用知之甚少。
实验设计
本研究使用宏基因组测序手段,对9名发生NEC的早产儿和14名未发生NEC的胎龄匹配的早产儿的DNA肠道病毒组进行了特征分析。
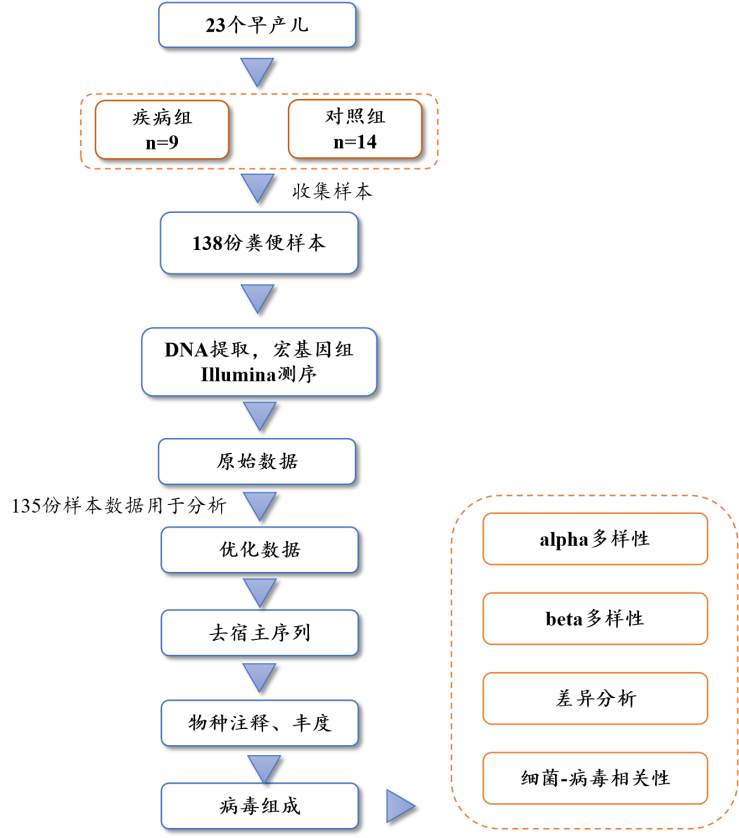
图1 实验设计
实验结果
1. 早产儿病毒群的组成随时间的推移在婴儿内部和婴儿之间有所不同
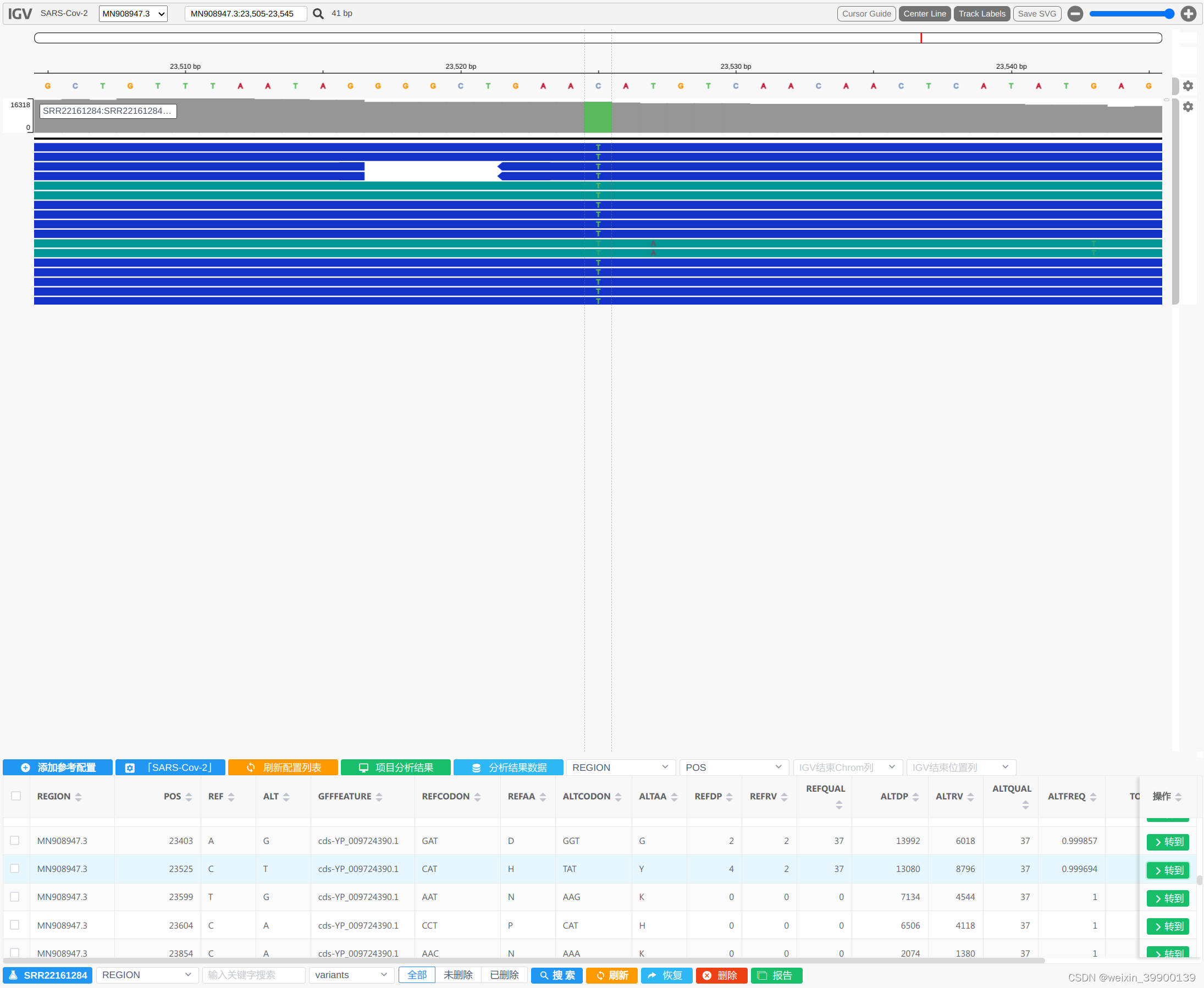
本研究收集到的样本特征如表1所示,疾病组婴儿的Postmenstrual年龄(PMA)(定义为出生时孕周加出生后年龄)为24.9 - 34.2周,而对照组的婴儿是25.0 - 36.1周之间。对照组婴儿的日龄为6.5-75.1,病例组婴儿为2.4-58.2。从婴儿粪便样本中共收集了778,612条contigs,其中40,210条被鉴定为病毒contigs。
表1 样本疾病-对照组样本特征
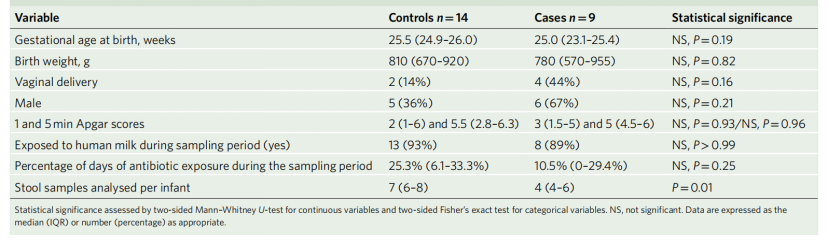
对照组早产儿的病毒组中有很大一部分无法进行科水平的分类(定义为未分类病毒)(图2a)。可分类的病毒群属于噬菌体病毒科,包括Myoviridae、Podoviridae和Siphoviridae。在PMA的第26周到第37周,每周内对照组婴儿的噬菌体和真核病毒科相对丰度都有所不同。随着时间的推移,个体内部的病毒科水平相对丰度也会发生变化。病毒群落丰富度和shannon多样性在个体内部和个体之间存在差异(图2b)。
通过β多样性分析,比较了对照组早产儿样本之间的病毒组。Bray-Curtis相异度,解释了病毒存在-缺失和病毒丰度,在婴儿内部明显低于婴儿之间(曼-惠特尼u检验,P<0.0001)。PCoA分析结果显示不同PMA年龄获得的样本有大量重叠,非参数多元方差分析(PERMANOVA)检验显示与PMA显著相关(P=0.05)。综上所述,这些结果表明了早产儿肠道病毒组在个体间和个体内的高度变异。
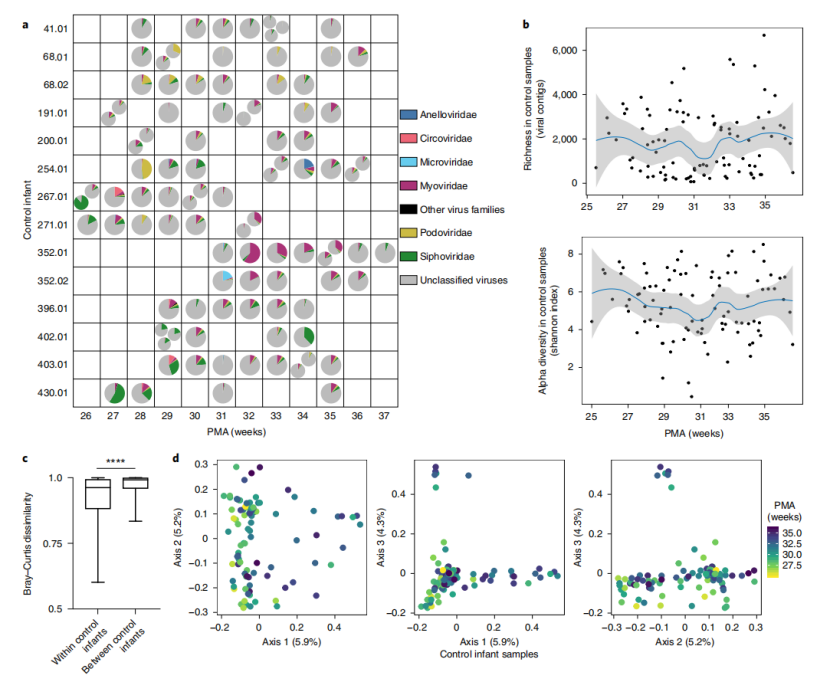
图2 未发生NEC的早产儿肠道病毒组(对照组)
2. 早产儿NEC疾病组的婴儿病毒组因年龄而异
NEC疾病组中发病的婴儿年龄中位数为31.1周PMA,有4例婴儿死亡。与对照组早产儿一样,很大一部分病例婴儿病毒组无法按科水平分类(即未分类病毒),可分类的病毒contigs包括噬菌体Myoviridae,Podoviridae和Siphoviridae,相对丰度中位数分别为5.6%、2.7%和2.9%(图3a)。与对照组一样,Microviridae仅在1个样本中存在较高的相对丰度(55.4%),而在其他样本中相对丰度较低。一些样本含有属于Anelloviridae和Circoviridae的真核病毒。
疾病组样本中病毒shannon多样性和丰富度随着时间的推移在个体之间变化(图3b),但并没有随着PMA显著变化。与对照组婴儿一样,疾病组婴儿个体内的Bray-Curtis相异度显著小于个体间(图3c)。PCoA分析没有显示基于PMA的聚类。
进一步通过PCoA比较了疾病组婴儿和对照组婴儿的病毒组组成(图3e),疾病组和对照组样本有明显重叠,而PERMANOVA检测显示两组间无显著差异(P > 0.99)。
图3 发生NEC(疾病组)的婴儿肠道病毒随时间的变化
3. 病毒组聚集先于NEC发作
本研究通过病例中与NEC发病时间相关的病毒进展,考虑了病毒群落动态可能影响NEC发展的可能性。研究人员设置一个7d的滑动窗口,窗口间的步长为2d,从NEC发生当天起反向计数。发现疾病组婴儿之间的Sorensen差异(考虑病毒存在-缺失)在NEC发病前10天的窗口中下降。在NEC发生前的这一时期内,对照组中匹配样本之间的差异是稳定的。(图4a,蓝色)。在NEC前的11-4d、9-2d和7-0d窗口,疾病组间的差异小于对照组间的差异。这表明疾病组婴儿肠道病毒组的beta多样性在NEC发病前约10天开始聚集。
采用LEfSe分析识别NEC发病前10天期和NEC发病前11-46天的病毒contigs。结果确定了NEC发病前0-10d相关的137个病毒contigs(NEC相关的contigs),而只有11个病毒contigs与NEC发病前11 - 46d相关(图4b)。接下来,通过比较NEC相关contigs的患病率和丰度来验证鉴别分析。在NEC前10-25d的病例样本中识别出NEC相关的contigs;但是发病率和平均丰度在NEC发生前10天显著增加(图4c)。NEC相关contigs的总体相对丰度较低,这表明低丰度病毒的变化与NEC病毒体风险趋同有关。
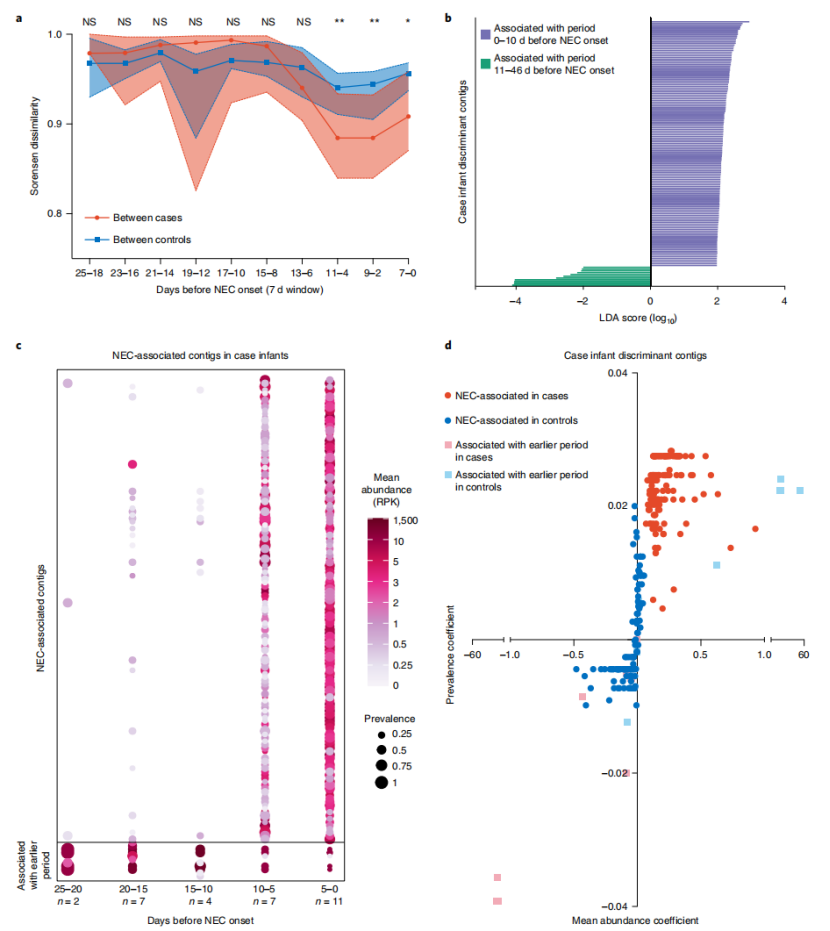
图4 NEC发病前的病毒聚集
4. EC发病前细菌-病毒相互作用
考虑到病毒聚集可能反映了NEC发病前细菌微生物组的变化的可能性,因此,使用了类似的方法来检查从这些样本中获得的细菌测序数据。在疾病和对照组中发现的主要细菌类群包括Gammaproteobacteria,Clostridia和Bacilli(图5a)。不同于病毒beta多样性,疾病组婴儿的细菌beta多样性在NEC发病前25天是稳定的(图5b)。在此期间,疾病组婴儿样本的加权UniFrac距离显著小于对照组婴儿样本,而未加权UniFrac距离则不显著(图5b)。没有在疾病组婴儿样本中观察到细菌微生物组的聚集,可能是因为疾病组细菌beta多样性在NEC前18-25d已经很低了。
最后,使用线性混合模型研究了病毒组和细菌微生物组之间的相互作用,以确定病毒和细菌丰度之间的相关性。结果表明,NEC相关的病毒contigs在疾病组婴儿样本中与特定的细菌属相关,但在对照组婴儿样本中不遵循相同的相关模式(图5c)。总的来说,这些结果表明发生NEC的病例婴儿样本的病毒-细菌相互作用与未发生NEC的对照组婴儿样本有很大的不同。
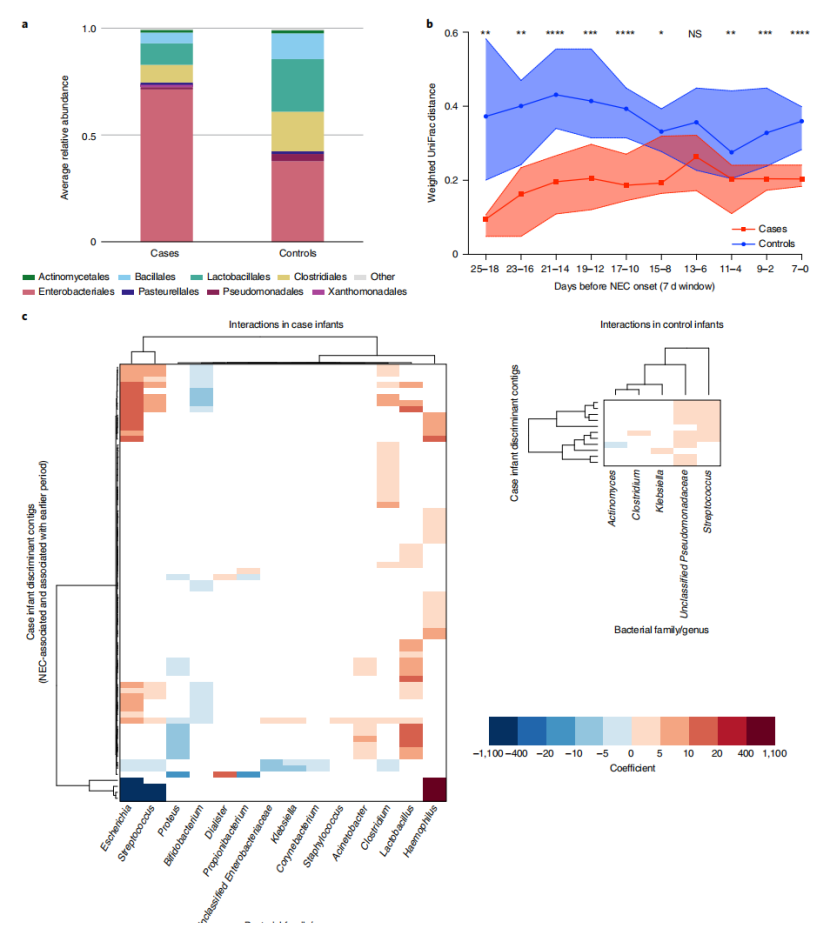
图5 NEC发病前的细菌微生物群稳定性和病毒-细菌相互作用
研究结论
综上所述,本研究观察到,在没有亲缘关系的早产儿之间,肠道病毒组在个体间存在显著差异,而个体间随时间的变化显著较少。本研究确认了NEC发病前肠道内的病毒和细菌特征。具体来说,NEC发病前10天内病毒β多样性趋于减少,这是由特定的病毒特征驱动的,并伴随着特定的病毒-细菌相互作用。结果表明,细菌和病毒的扰动先于NEC的突然发作。这些发现表明,早产儿的早期生命病毒组特征可能与NEC有关。

拓展阅读
重磅!首次揭露中国人群血液病毒组特征
参考文献
Longitudinal gut virome analysis identifies specific viral signatures that precede necrotizing enterocolitis onset in preterm infants. Nature microbiology, 2022.