1.Nat Commun:科学家开发出新型基因编辑工具来纠正诱发人类遗传性疾病的突变
doi:10.1038/s41467-021-21559-9
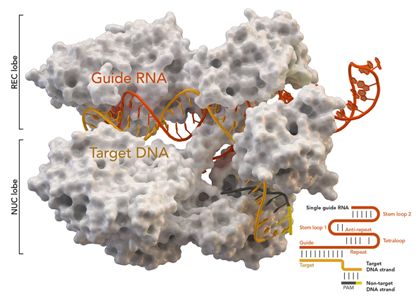
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自新加坡A*STAR研究所等机构的科学家们通过研究开发了一种名为C-G碱基编辑器(CGBE, C-to-G Base Editor)的基于CRISPR的基因编辑器,其或能帮助纠正诱发人类遗传性疾病的突变。
图片来源:Agency for Science, Technology and Research (A*STAR),Genome Institute of Singapore (GIS)。
CGBE编辑器推动了科学家们广泛采用CRISPR-Cas9技术来使得对人类基因组进行“分子手术”成为可能,CRISPR-Cas9技术目前能用来干扰靶向基因,但当需要对特定序列进行精确更改时,这种技术的效率就会降低;而CGBE编辑器能通过实现有效和精准的基因改变来解决科学家们所面临的问题;其主要由三部分组成:1)修饰后的CRISPR-Cas9能定位突变的基因并将整个编辑器聚焦于这一基因;2)一种能从化合物种移除氨基基团的脱氨酶能靶向缺失的碱基C,并将其进行替换;3)最后,蛋白质能够开启细胞机制来利用碱基G取代有缺陷的碱基C;这就能够帮助研究人员实现从C到G的直接转换,并能纠正突变从而治疗人类遗传性疾病。
2.Nature子刊:CRISPR技术揭示癌症扩散的机制
doi:10.1038/s42003-021-01912-w
近日,惠康桑格研究所(Wellcome Sanger Institute)科学家的最新研究表明,以前与癌症无关的基因在某些癌症向肺部的扩散中起关键作用。研究小组发现,当基因LRRN4CL在小鼠中过度表达时,皮肤癌黑色素瘤更可能转移到肺部。
该研究于近日发表在《Communication Biology》杂志上,该研究还证实LRRN4CL的过表达与结肠癌,乳腺癌和膀胱癌向肺的转移有关。
3.eLife:新型全基因组CRISPR筛选技术或能发现与癌症发生相关的关键通路
doi:10.7554/eLife.63603
近日,一项刊登在国际杂志eLife上的研究报告中,来自范德堡大学等机构的科学家们通过研究开发了一种新型全基因组CRISPR筛选技术,其或能帮助揭示80%-90%的肿瘤是如何生长的。这种新方法能够检测一种特殊的遗传开关,而该开关能诱导持续性的细胞分裂(癌症开始的标志物)。

图片来源:Fomicheva。
文章中,研究人员共对4000万个上皮细胞进行了筛选,来避免错过任何可能的筛选,但要想在如此庞大的数量中找到一个令人感兴趣的基因就好像大海捞针一样困难;为了解决这个问题,研究人员开发了一种策略,即利用不同的颜色来标记处于不同细胞周期阶段的细胞,从而对其进行分类,在筛选过程中,研究人员发现了一种众所周知的肿瘤抑制因子NF2。让他们惊讶的时,通过剔除激活机体先天性免疫力的蛋白TRAF3,细胞就会停止接收休息信号。尽管此前他们并未发现TRAF3与密度依赖性的细胞增殖相关,但本文研究结果表明,如果没有该蛋白的话,无论细胞生长地多密集,其都会继续进行分裂;这一特征与癌症发生有关,因此这一特征或许具有重要的意义。
4.Nat Commun:新方法促进抗体类药物开发
doi:10.1038/s41467-021-21518-4
近年来,治疗性抗体已经改变了癌症和自身免疫性疾病的治疗方法。现在,瑞典隆德大学的研究人员基于 “遗传剪刀” CRISPR-Cas9开发了一种新的高效方法,该方法可促进抗体开发。该发现发表在《Nature Communications》杂志上。
抗体药物是增长最快的一类药物,几种治疗性抗体用于治疗癌症。它们有效,通常无副作用,并通过识别体内异物而受益于人体自身的免疫系统。通过与细胞上的特定靶分子结合,抗体可以激活免疫系统,或引起细胞“自杀”。
5.Stem Cells:GLI1基因有助于治疗多种癌症
doi:10.1002/stem.3341
近日,芝加哥安·罗伯特·H·卢里儿童医院的斯坦利·曼恩儿童研究所的科学家发现,促癌的GLI1基因的DNA内的一个区域直接负责调节该基因的表达。这些发现发表在《Stem cell》杂志上,暗示GLI1内的这一区域可能被作为癌症治疗的靶标,因为关闭GLI1会打断癌症的过度细胞分裂特性。
共同资深作者Philip Iannaccone教授说:“从以前的研究中,我们知道GLI1驱动着导致许多癌症的持续的细胞增殖,而且该基因也刺激了它自身的表达。我们在人类活体胚胎干细胞中建立了去除GLI1调控区的功能,从而消除了GLI1的表达并阻断了其活性。这些发现是有希望的,并且可能指向癌症的治疗靶标。”
Iannaccone博士及其同事使用CRISPR基因编辑技术删除了人类胚胎干细胞中GLI1 与DNA的结合区,从而干扰了该基因驱动血液,骨骼和神经细胞胚胎发育的正常活动。
6.Science Advances:微针辅助基因组编辑可协同治疗炎症性皮肤病!
doi:10.1126/sciadv.abe2888
近日,来自中国浙江大学的一个研究小组在Science Advance上发表题为《Microneedle-assisted genome editing: A transdermal strategy of targeting NLRP3 by CRISPR-Cas9 for synergistic therapy of inflammatory skin disorders》的研究论文。
该研究发现利用微针辅助基因组编辑技术,使CRISPR-Cas9蛋白经皮靶向控制炎症因子合成基因,可协同治疗炎症性皮肤疾病。
7.Science:CRISPR基因沉默机制开拓慢性疼痛新疗法
doi:10.1126/science.abi4517
近日,美国加州大学圣地亚哥分校的一个研究小组在顶尖期刊Science上发表题为《Gene-silencing injection reverses pain in mice》的研究论文。
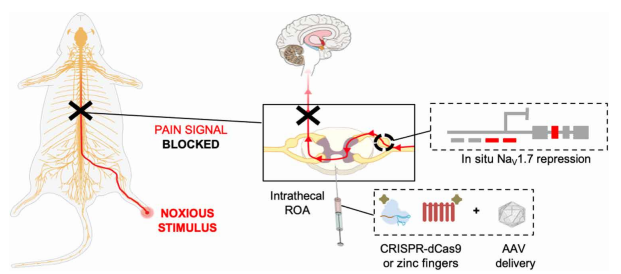
通过鞘内给药途径(ROA)总体策略图。
研究通过一项有趣的验证研究表明,CRISPR基因疗法可能是治疗慢性疼痛的阿片类药物的替代品。初步研究结果表明,在暂时抑制与疼痛状态相关的基因活动后小鼠的疼痛敏感性降低。
8.Molecular Therapy:治一次管3年!基因编辑展现长效降低胆固醇能力
doi:10.1016/j.ymthe.2021.02.020
最近,由美国宾夕法尼亚大学基因治疗专家团队发表在Molecular therapy杂志上的新研究,通过对PCKS9基因的编辑,实现了基因编辑治疗的两个关键目标:安全性和持久性。研究首次报道,一次性基因编辑可以显著降低动物体内的PCSK9蛋白和LDL-C水平长达3年之久!
研究人员使用了由Precision BioSciences公司开发的ARCUS基因组编辑技术平台。试图确定通过腺相关病毒(AAV),将靶向PCSK9基因的上述编辑西永递送到非人灵长类动物(NHP)肝脏中,随后进行长达3年的监测。
结果显示,经过治疗的动物表现出循环PCSK9和LDL-c的持续减少,其中PCSK9蛋白水平持续降低了85%,而LDL-C水平持续降低56%。同时PCSK9位点的基因编辑十分稳定,脱靶率低,肝脏组织病理没有发现明显的不良变化。
此外,在3年期间,肝脏细胞已经经历了多次的迭代,这些结果意味着基因编辑对基因组的改变被传递到新一代的肝细胞中,支持PCSK9和LDL-C水平的降低是永久性的。这些研究表明,体内靶向基因破坏发挥了持久的治疗效果,同时并没有发生明显的不良反应,因此结果支持临床转化。
【科研前沿211期】CRISPR基因敲除实验protocol
CRISPR workflow实操案例教程