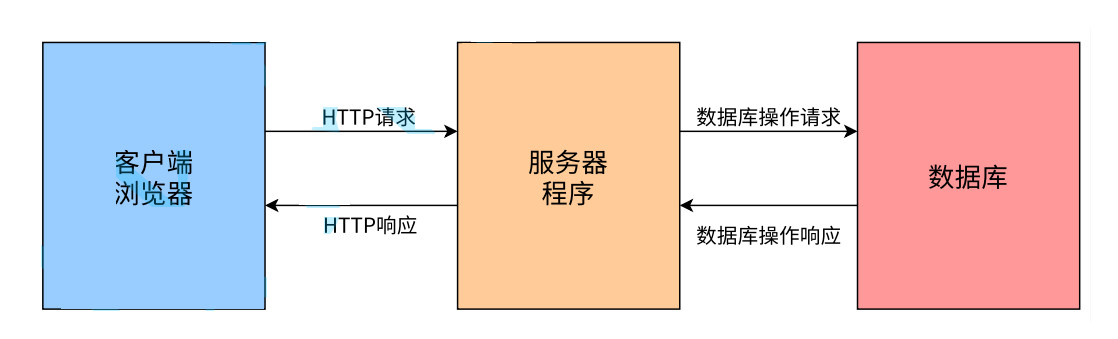
摘要
自主神经系统和中枢神经系统之间的相互作用对人脑功能和健康的相关性尚不清楚,尤其是当这两个系统都受到睡眠剥夺(SD)的挑战时。本研究测定了健康参与者的大脑活动(采用fMRI)、脉冲和呼吸信号,以及β-淀粉样蛋白负荷(采用PET)。研究结果发现,相对于休息时的清醒状态(RW),SD导致与自主神经系统相关网络(AN)中的低频(LF,<0.1Hz)活动显著增加,包括背侧注意力、视觉和感觉运动区域,本研究先前的研究工作发现这些区域与LF脉冲信号变化(受交感神经调节)具有一致的时间耦合。SD导致脉冲信号的LF分量与中脑网状结构中具有峰值效应的内侧网络之间,以及呼吸变化的LF分量(由呼吸运动输出调节)与小脑网络之间具有显著的相位相干性。在SD期间,AN的LF功率与脉冲-内侧网络和呼吸-小脑网络的相位相干性显著且独立相关(总调整R2=0.78)。在SD(而非RW)期间,AN的较高LF功率与较低的基线β-淀粉样蛋白负荷相关(Cohen's d=0.8)。总之,SD触发了一种大脑同步活动的自主模式,这种模式与特定的自主-中枢神经系统相互作用有关。研究结果揭示了全局同步与大脑清除机制的直接相关性。
前言
大脑静息态活动的生理信息是理解大脑功能结构的基础,并且可以为神经精神疾病提供重要见解。大量研究表明,外周自主神经系统功能与大脑活动之间存在着密切的关联。一个明显的例子是自主神经系统的交感神经分支,对维持血管稳态具有重要作用。有人认为,与外周交感神经张力相关的fMRI信号在一定程度上可以反映血管现象。然而,对血管张力不太敏感的成像技术(如EEG、MEG和PET-FDG)也揭示了大脑活动与外周交感神经张力标志物之间的关联。此外,自主神经系统和中枢神经系统的耦合变化与认知表现和个性特征相关,突显了它们与人类行为的相关性。然而,更深层次的机制见解需要干预调节自主神经功能和大脑活动。
睡眠剥夺(SD)是一种已知会引起自主神经和中枢神经系统复杂变化的干预措施。相对于休息时的清醒状态(RW),睡眠剥夺期间的静息态fMRI显示视觉和感觉运动皮层的低频(LF,<0.1)活动和连接性增加,同时一些研究还报告了其他皮层和皮下核区域活动的降低。睡眠剥夺增加了与警觉和觉醒波动相关的fMRI全局信号变异性。睡眠剥夺对自主神经功能的影响包括交感神经张力增加、副交感神经张力和呼吸运动输出降低。最近,我们观察到脉冲中的低频波动(受外周交感神经张力调节)和自主神经网络(包括视觉、背侧注意和感觉运动区域)中的fMRI信号之间存在显著的时间耦合。虽然睡眠剥夺影响了类似的大脑区域活动,但目前尚不清楚这些效应是否由大脑与外周信号之间的相互作用变化所驱动。
先前的研究表明,生理和心理状态下的大脑活动与外周信号之间存在显著的时间耦合。然而,目前尚不清楚大脑和外周低频振荡的耦合程度是否与脑局部活动直接相关。为了解决这个问题,本研究采集了高分辨率fMRI数据,并结合脉冲和呼吸变异(RV)的外周测量值(两个指标都受到SD的影响)。为了评估睡眠剥夺引起的大脑活动变化的自主性质,以及受到相位耦合振荡的Kuramoto模型的启发,本研究检验了以下假设,即睡眠剥夺期间的同步低频(LF)活动增加与外周和大脑信号之间的相位耦合增强相关。自主神经系统和中枢神经系统被认为与脑废物清除有关。例如,睡眠中的自主神经反应与基线β-淀粉样蛋白负荷有关。此外,同步的δ波与胶质淋巴系统清除功能有关,并在睡眠剥夺期间得到增强。因此,本研究假设大脑同步的自主相关能力增强与基线β-淀粉样蛋白负荷降低(在RW期间测定)相关。
材料和方法
参与者
在美国国立卫生研究院招募了22名健康个体,其中20名(10名女性,年龄:39.8±10.4岁,范围:22-72岁)完成了这项研究。纳入标准为男性或女性,年龄至少18岁,并且能够提供书面知情同意书。排除标准包括:精神药物尿检阳性、酒精或药物使用障碍史、当前或既往神经或精神疾病史(包括认知障碍)、过去一个月内使用过精神活性药物(即阿片类镇痛药、兴奋剂、镇静剂)、目前正在服用处方药(即抗组胺药、抗高血压药、抗生素)、可能改变大脑功能的疾病;心血管和代谢疾病,以及意识丧失时间超过30min的头部创伤史。此外,根据病史和自我报告,患有问题性失眠(大多数时间睡眠困难)、嗜睡症、阻塞性睡眠呼吸暂停或异常睡眠模式(包括但不限于使用C-PAP机、白天睡觉、使用药物入睡、每晚睡眠少于5小时和夜班工人)的参与者未被纳入研究。所有参与者均提供了参与本研究的书面知情同意书,该研究获得了NIH机构审查委员会的批准。采用匹兹堡睡眠质量指数问卷来评估睡眠质量(睡眠时间:7.32±0.92h,总分:2.95±1.79分)。
睡眠剥夺(SD)和清醒状态(RW)条件
每个参与者在两种情况下进行脑成像:一次是在一晚睡眠后(RW),一次是在一晚睡眠剥夺后(SD)。对于RW和SD条件,参与者在扫描前都要在NIH的临床中心过夜。午夜后不进食,研究开始前24小时停止饮用含咖啡因的饮料。在RW条件下,护士从晚上10:00到早上7:00(这是他们从睡眠中醒来的时间)每小时监测参与者是否睡着。在SD条件下,参与者在睡眠剥夺之夜前的早晨8:00起床,并在抵达临床中心时由一名护士持续陪同,以确保他们整晚及第二天早上保持清醒。参与者在扫描当天吃完早餐后,并在护士的监督下一直到上午9:00左右开始MRI扫描,持续约2小时。在SD条件下,参与者在静息态fMRI扫描后总共保持清醒约25.5小时。RW和SD条件的顺序在参与者之间是平衡的(平均间隔9.5天)。
MRI和生理数据收集
参与者在3.0 T Magnetom Prisma扫描仪(Siemens Medical Solutions,USA,Inc.,Malvern,PA)中使用32通道头部线圈进行MRI检查。参与者在黑暗的房间里放松,睁开眼睛,同时观看黑暗背景上显示的明亮十字注视点时,采集静息态fMRI图像。数据采集包括梯度回波平面成像(EPI)序列,多波段因子为8、AP相位编码方向、重复时间(TR)为720ms、回波时间37ms、翻转角52°、矩阵大小为104×104、72个层、各向同性体素大小2mm和820个时间点,采集时间为9.84min。将每个session的前10个时间点排除在后续分析之外,使fMRI信号趋于稳定。在fMRI过程中,使用BIOPAC(BIOPAC Systems Inc.,Goleta,CA)以2000Hz的采样率采集光电容积脉搏波(脉冲)信号(来自左手食指)、RV(呼吸带)和扫描仪触发信号。此外,本研究还采集了T1加权3D MPRAGE(TR/TE=2400/2.24ms,0.8mm各向同性分辨率)和T2加权自旋回波多层(TR/TE=3200/564ms,0.8mm平面内分辨率)序列。T1w和T2w图像是在RW期间(n=17)或没有睡眠限制的另一天(n=3)采集的。
MRI和生理数据处理
使用人类连接组项目(HCP)公布的最小预处理流程对MRI数据进行处理。具体来说,使用FreeSurfer v5.3(https://surfer.nmr.mgh.harvard.edu/)进行解剖数据分割。此外,使用牛津大学脑功能磁共振成像中心(FMRIB)软件库(FSL)(http://www.fmrib.ox.ac.uk/fsl)和AFNI的例程,对fMRI数据进行时间层校正、畸变校正和空间标准化。仔细检查标准化的质量,特别是脑干和小脑区域。对fMRI数据不进行额外的预处理。基于同时记录的扫描仪触发信号,在MATLAB(MathWorks,Inc.,Natick,MA,USA)中识别并提取与静息态fMRI会话对齐的脉冲和RV信号片段并分别进行检查。
低频功率和相位估计
在AFNI中使用“3dRSFC”功能对LF(0.01-0.1Hz)波动分数幅度(fALFF)进行初始体素分析,以确定从RW到SD的LF波动总体增加的区域。然后,计算已识别脑区的平均fMRI信号,并使用MATLAB中的“bandpower”函数来估计相对于总信号功率的LF功率。本研究还估计了均值方差归一化外周信号的LF功率。为了评估大脑fMRI和外周信号之间的时间耦合,本研究进行了相位分析,该分析对噪声相关的瞬时信号幅度变化(例如与运动相关的信号)相对稳健。具体来说,在全脑掩模内,本研究计算了每个体素的fMRI信号z值和降采样外周信号之间的交叉功率谱密度(CPSD)。采用重叠率为50%的周期性汉明窗,对128个频点(frequency bins)进行CPSD计算。每个频点的相位滞后计算为CPSD实部/虚部的四象限反正切函数。LF相位是通过取0.01-0.1Hz相位测量值的均值来计算的。
局部对全局信号的贡献
在RW和SD条件下,在全脑掩模中计算每个参与者的全局信号。本研究使用AFNI的'3dTcorr1D'函数计算体素水平与全局信号的相关性来评估局部的贡献。在进行统计比较之前,对这些相关性图像进行Fisher's z转换。使用[18F]florbetaben示踪剂进行PET成像。根据组织病理学评估,这种示踪剂与细胞外β-淀粉样蛋白聚集物结合,并且对检测早期β-淀粉样蛋白沉积具有敏感性。本研究仅使用在RW中收集的PET数据来评估大脑中β-淀粉样蛋白的基线水平。3名受试者RW的PET数据采集时间与RW的fMRI数据采集时间不同。在PET成像期间,参与者在昏暗的环境中休息,并要求保持睁眼。为了最小化与运动相关的图像模糊,使用Polaris Vicra(Northern Digital)头部追踪系统记录头部运动,并应用逐帧运动校正。为了量化β-淀粉样蛋白负荷,使用简易化参考组织模型2和小脑灰质参考区域计算结合电位的体素估计,即配体与区域内结合位点之间的相互作用程度。
ROI分析
为了更好地定位与外周信号有显著相位关联的脑干和小脑区域的体素效应,本研究计算了每个参与者在脑干、间脑和小脑ROIs中的大脑和外周信号之间的平均LF相位,并在组水平上计算了从RW到SD条件下LF相位变化的效应大小(Cohen's d)。
结果
睡眠剥夺(SD)对外周和大脑fMRI信号的影响
相对于RW,SD提高了脉冲信号的LF功率(p=0.020)(图1A)。虽然RV的LF功率增加不显著(p=0.39),但是LF频率的峰值向较低的范围偏移(图1B)。SD显著增加了视觉、背侧注意和感觉运动区域灰质中的fALFF(pFWE<0.05),与之前获得的AN图(包括海马旁回、海马回和丘脑核)有显著重叠(图1C-E)。由于SD期间fALFF增加的区域与先前获得的AN图高度重叠,本文中将这些区域称为AN,并计算了RW和SD条件下区域对全局信号的影响。在RW中,单样本t检验显示楔前叶、尾状核、额下回、中回、上回、内侧回、上顶叶和下顶叶、中央前回和中央后回,以及楔状回对全局信号的影响最大(pFWE<0.05),而RW和SD之间的配对t检验显示,在SD条件下,与AN重叠的区域对全局信号的影响增加(pFWE<0.05)。

图1.大脑和外周信号的低频变化。
大脑-脉冲相位耦合
在RW条件下,对大脑fMRI信号与脉冲之间的LF相位耦合进行体素水平的单样本t检验,结果发现感觉运动区、颞叶、枕叶区域有显著的LF相位耦合(pFWE<0.05,图2A)。在SD条件下,额叶、顶叶、颞叶、枕叶、边缘叶、基底节、中脑和小脑后叶的大部分灰质区域中,大脑与脉冲之间存在显著的LF相位耦合(pFWE<0.05)。接下来进行体素配对t检验,以确定条件之间相位变化最显著的区域,结果显示双侧中脑网状结构中出现了具有峰值效应的内侧网络。其他内侧网络区域包括丘脑、额上回、额内侧回、前扣带回和后扣带回、楔前叶(pFWE<0.05,图2B)。RW条件下的内侧网络-脉冲相位不显著(RW相位:0.03±0.18 rad,p=0.45),但在SD中非常显著(SD相位:-0.38±0.24 rad,p<0.001)。对脑干和间脑的感兴趣区域(ROI)分析显示,中脑网状结构、中缝尾侧核、楔状核、下丘和上丘、微细胞被盖核、脚桥被盖核、黑质、VTA、内侧膝状体核和(右侧)底丘脑核的相变效应较大(Cohen’s d>0.8)。

图2.大脑和外周之间的LF相位关联。
大脑-呼吸变异(RV)相位耦合
在RW条件下,对大脑fMRI信号与RV之间的LF相位耦合进行体素水平的单样本t检验发现,视觉皮层和颞叶皮层、边缘叶、丘脑、楔前叶和白质区域之间存在显著的LF相位耦合(pFWE<0.05,图2)。在SD条件下,大脑与RV在小脑、颞叶和顶叶区域之间存在显著的LF相位耦合(pFWE<0.05)。RW和SD之间的体素配对t检验显示,脑-RV相位最显著的变化主要在小脑网络,包括小脑后叶,但也发生在扣带中部和白质区域(pFWE<0.05,图2D)。小脑网络与AN无重叠。RW条件下的小脑网络-RV相位耦合不显著(RW相位:0.03±0.10 rad,p=0.24),但在SD条件下非常显著(SD相位:-0.22±0.18 rad,p<0.001)。此外,SD显著改变了右前岛叶和RV之间的LF相位(pFWE<0.05)。在RW条件下,前岛叶-RV相位耦合显著(RW相位:-0.18±0.13 rad,p<0.001),但在SD中不显著(SD相位:0.05±0.18 rad,p=0.23)。小脑区域的ROI分析显示,双侧VIIIa、(右侧)VI小叶以及间位核的相变效应较大(Cohen’s d>0.8)。
SD期间大脑活动的自主性质
在RW和SD条件下,AN的LF功率没有关联(r(18)=0.10,p=0.67),这表明不同的过程导致了每种条件下的LF波动。平均帧间位移(运动指数)与RW期间AN的LF功率相关(r(18)=0.49,p=0.028),但与SD期间AN的LF功率不相关(r(18)=0.05,p=0.82)。在RW和SD条件下,年龄与AN的LF功率无关。为了评估SD期间AN活动的自主性质,本研究测试了AN的LF功率是否与内侧网络-脉冲相位和小脑网络-RV相位相关。在RW条件下,AN的LF功率与内侧网络-脉冲相位呈显著正相关,而与小脑网络-RV相位不相关。在SD条件下,AN的LF功率与内侧网络-脉冲相位和小脑网络-RV相位呈显著负相关。在RW和SD条件下,前岛叶-RV相位与AN的LF功率无关。去除年龄效应后,AN的LF功率与内侧网络-脉冲相位和小脑网络-RV相位之间的相关性没有明显变化(ΔR2<0.06)。本研究使用稳健线性回归从内侧网络-脉冲和小脑网络-相位测量来预测每种条件下AN的LF功率。在RW条件下,总调整后R2=0.31,而在SD条件下,总调整后R2=0.78。RW与SD条件下的调整后R2存在显著差异(p=0.016)。进一步的模型分析显示,两种条件下的清醒状态(SD vs.RW)与内侧网络-脉冲相位存在显著交互作用(p<0.001),而与小脑网络-RV相位之间无显著交互作用(p=0.28)。
AN和β-淀粉样蛋白负荷的LF功率
本研究评估了基线β-淀粉样蛋白负荷(在RW条件下测量)是否与AN的LF功率(在RW和SD条件下测量)以及年龄有关。在所有参与者中,SD条件下较高的AN LF功率与楔前叶、枕区、海马旁回和梭状回的β-淀粉样蛋白负荷降低有关(图3A)。值得注意的是,在SD条件下,β-淀粉样蛋白负荷的个体差异与AN的LF功率相关,也与SD期间的内侧网络-脉冲相位和小脑网络-RV相位相关。年龄越大,大脑额叶、颞叶、中央前回和中央后回、楔前叶的β-淀粉样蛋白负荷越高(图3A)。图3B显示了全脑β-淀粉样蛋白负荷与年龄和AN的LF功率之间的Fisher’z转换相关性直方图。在SD条件下,β-淀粉样蛋白负荷与年龄和AN的LF功率之间的关联有较大的效应量,但在RW条件下没有。在去除年龄效应后,β-淀粉样蛋白负荷与SD条件下AN的LF功率仍然相关。
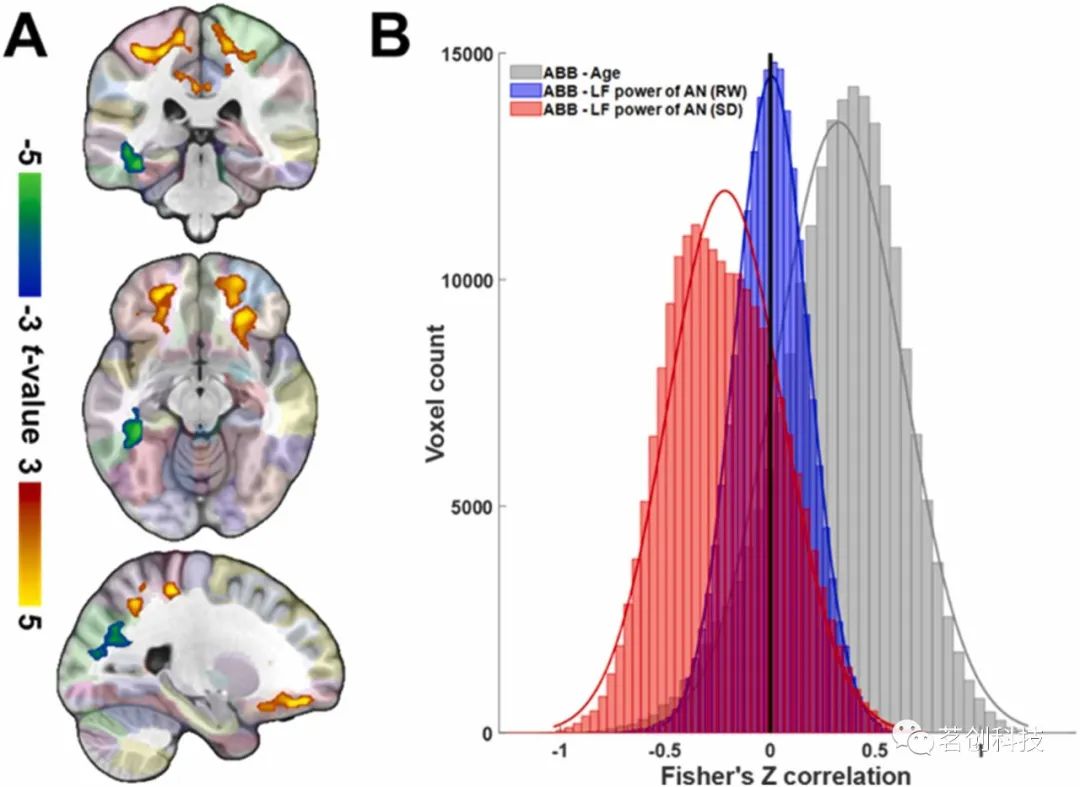
图3.与大脑β-淀粉样蛋白负荷(ABB)的关联。
结论
本研究基于外周信号和大脑之间的相互作用,提供了一种新的大脑活动特征。有研究表明,代偿机制可以减轻SD期间引起的视觉空间注意和感觉运动控制障碍,而SD引起的局部fMRI连接增强(在AN区域)对警觉性和认知表现具有代偿作用。本研究发现,SD期间同步AN活动增强的程度与内侧网络(包括中脑网状结构)和LF脉冲变化(受外周交感神经张力影响)之间,以及小脑区域与LF RV变化(受呼吸运动控制影响)之间的LF相位耦合增强有关。目前的研究结果并没有提供自主神经功能改变与大脑同步变化之间的因果关系,但这些观察结果可以为同步大脑活动的计算模型(如Kuramoto模型)提供实证证据,从而更好地解释中枢和自主神经系统之间相位耦合振荡对皮层同步的影响。
参考文献:Ehsan Shokri-Kojori, Dardo Tomasi, Sukru B.Demiral, Gene-Jack Wang and Nora D. Volkow, An Autonomic Mode of Brain Activity, Progress in Neurobiology, (2023). doi:https://doi.org/10.1016/j.pneurobio.2023.102510
小伙伴们关注茗创科技,将第一时间收到精彩内容推送哦~
![[webpack] 基本配置 (一)](https://img-blog.csdnimg.cn/e2660dba3be44309a600a9839c2b27e5.png)