重要性:老年抑郁症(LLD)的临床表现具有相当大的异质性。揭示这种异质性可能有助于阐明LDD的发病机制,并有助于精准和个性化治疗LDD。
目的:横向和纵向描述与神经解剖学、认知功能、临床症状和遗传图谱相关的LLD异质性。
实验设计和被试:基于影像的衰老和神经退行性疾病坐标系(iSTAGING)研究是一个国际多中心联盟,汇总了13项研究的数据以研究大脑老化,参与人数超过35000,其中包括部分患有重度抑郁的被试。本研究分析了来自多中心样本(N=996)的多模态数据:包括神经影像学数据、神经认知评估数据和遗传学数据。采用半监督聚类方法(通过判别分析的异质性)对区域灰质(GM)脑容量进行维表征。数据收集时间为2017年7月至2020年7月,数据分析时间为2020年7月至2021年12月。
主要成果和措施:确定了两个维度来描绘体素级GM map、白质(WM)分数各向异性、神经认知功能、临床表型和遗传学中的LLD相关异质性。
结果:研究共纳入501名LLD患者(平均年龄67.39岁[SD=5.56];332名女性)和495名健康对照(平均年龄66.53岁[SD=5.16];333名女性)。与健康对照相比,维度1患者的脑解剖结构保存的相对完好且WM没有被破坏。相比之下,维度2的患者却表现出了广泛的脑萎缩和WM完整性被破坏,同时伴有认知障碍和更严重的抑郁。此外,发现1个新的独立遗传变异(rs13120336;染色体:4, 186387714;次等位基因,G)与维度1显著相关(优势比,2.35;SE,0.15;P=3.14×108)但与维度2不相关。2个维度显示,在一般人群中(UK Biobank数据N=12518)基于单核苷酸变异的显著遗传率为18%~27%。在纵向测量个体中,维度2个体的GM和脑龄的纵向变化更快(Cohen f2=0.03;P=0.02),与维度1个体(N=1431,来自ADNI、BLSA和BIOCARD 7224次扫描的数据集)相比,维度2个体更有可能发展为阿尔茨海默病(Cohen f2=0.03;P=0.03)。
结论与意义:本研究将LLD的异质性分为具有不同神经解剖学、认知、临床和遗传特征的两个维度。这种维度方法为研究LLD的异质性以及潜在维度与可能的疾病机制、临床结果和干预效果的相关性提供了一种潜在机制。本文发表在JAMA Psychiatry杂志。
关键点:
问题:老年抑郁障碍(LLD)是否与结构神经影像模式相关?
发现:在这项病例对照研究中,2个最能代表LLD患者的神经解剖学异质性的维度:一个与保留的大脑结构有关,另一个与弥散性结构异常和更大的认知障碍有关。1个新的独立遗传变异与维度1显著相关,但与维度2无关,并且维度2与阿尔茨海默病和大脑衰老的纵向相关性大于维度1。
意义:本研究中代表LLD异质性的2个维度,可能为LDD的临床诊断和精准预后提供帮助。
重度抑郁症是最常见的精神健康障碍之一,是世界范围内致残的主要原因。老年期抑郁障碍(late-life depression,LLD)是指存在于60~65岁及以上人群的重度抑郁障碍,可早发或晚发。在社区中,LLD会影响1.8%至7.2%的老年人。
LLD的临床表现和疾病进展存在相当大的异质性。药理和心理治疗在LLD中往往不如在其他成年年龄组的患者中有效。多达50%的LLD患者在第一次治疗中没有得到缓解。LLD与认知障碍、高共病率(包括心脑血管疾病和中风)以及肥胖、糖尿病、虚弱和神经退行性疾病(如阿尔茨海默病和血管性痴呆)的风险增加相关。
磁共振成像显示LLD的双侧前扣带回和内侧额叶皮质、岛叶、壳核和苍白球的灰质(GM)减少,且延伸到了海马旁回、杏仁核和海马。相比之下,在舌回、壳核和尾状核区域观察到的GM体积更大。扩散张量成像显示了白质(WM)完整性的大量破坏,包括丘脑前辐射、扣带、皮质脊髓束、上和下纵束和钩束。总的来说,研究结果支持LLD的生物学模型与特定脑网络中的皮质萎缩和WM异常相关,尽管相关的程度各不相同。
数据驱动的生物亚型的方法学发展对神经系统疾病(例如阿尔茨海默病和抑郁症)的传统定义带来了挑战。半监督聚类方法的优点之一是通过1~k映射从参照组(即健康对照)到患者组进行亚型划分,从而避免混淆聚类。不同的神经病理学机制可能是临床表型和异质性发展的基础。此外,遗传异质性影响表型表达或与表型表达相互作用的程度,几乎没被探讨过,且个体水平的变异(包括环境、遗传或其他因素),也可能导致不同程度的疾病易感性。
我们试图在一个大的、多中心的样本(N=996)中,通过半监督聚类方法(异质性判别分析[HYDRA])描述LLD患者的异质性。我们假设多个不同的维度可以描述潜在的异质性,且这些维度在一般人群和纵向轨迹中可能很显著。

方法
被试
基于成像的老年和神经退行性疾病坐标系(iSTAGING)是一个由多种成像协议、扫描仪、数据模态和病理学组成的国际联盟,包括来自13项研究的超过35000名参与者的磁共振成像数据,被试年龄范围较广(22至90岁)。本研究包括来自4个队列的LLD患者:UK Biobank(UKBB),加州大学旧金山分校心理疗法反应研究(UCSF),巴尔的摩老化纵向研究(BLSA),和正常个体认知衰退生物标志物(BIOCARD)。研究获得了每个站点机构审查委员会的批准,且所有参与者都提供了书面知情同意书。
我们采用统一的LLD定义标准来选择LLD被试,并排除可能伴随以下潜在医学和神经系统疾病的被试:所有4个站点的被试年龄被限制在60岁或以上;对于UKBB,我们排除了被诊断为精神分裂症、双相情感障碍、精神病症状、焦虑、强迫症、创伤后应激障碍、亨廷顿病、阿尔茨海默病、癫痫和中风、糖尿病或高血压的个体;对于BLSA,我们排除了被诊断为高血压、焦虑、双相情感障碍或精神分裂症的个体;对于BICARD,我们排除了被诊断为糖尿病或高血压的个体;对于UCSF,我们排除了滥用药物、有精神病特征、使用认知增强药物、有神经系统疾病或创伤后应激障碍的个体(Table)。我们额外定义了2个群体:普通群体(来自UKBB的12518名参与者)和纵向群体(来自ADNI、BLSA和BICARD的1431名参与者)。共纳入996名参与者(501例LLD和495名健康对照)。所有站点的图像协议和获取参数见附录。本研究的搜索词为晚年抑郁、异质性、半监督聚类和维度表征。数据收集时间为2017年7月至2020年7月,分析时间为2020年7月至2021年12月。
图像预处理
通过校正磁场强度控制图像质量。使用多图谱分割(MUSE)提取GM感兴趣区域。使用配准方法将颅骨剥离后的图像配准到蒙特利尔(MNI)空间,生成每个组织的体素级区域体积图。分数各向异性图用于检查WM的微观结构完整性。平均分数各向异性是在约翰霍普金斯大学国际联盟的48个WM区域内提取的,用于标记脑成像DTI-81 WM图谱。GM MUSE感兴趣区域的站点间图像校正详见附录1。
遗传学数据预处理
我们整合了通过质量控制协议的UKBB的成像-遗传数据集,得到20438名参与者和8430655个单核苷酸变体。然后我们选择了774名与LLD群体重叠的UKBB参与者进行遗传分析。
通过HYDRA发现多维表示
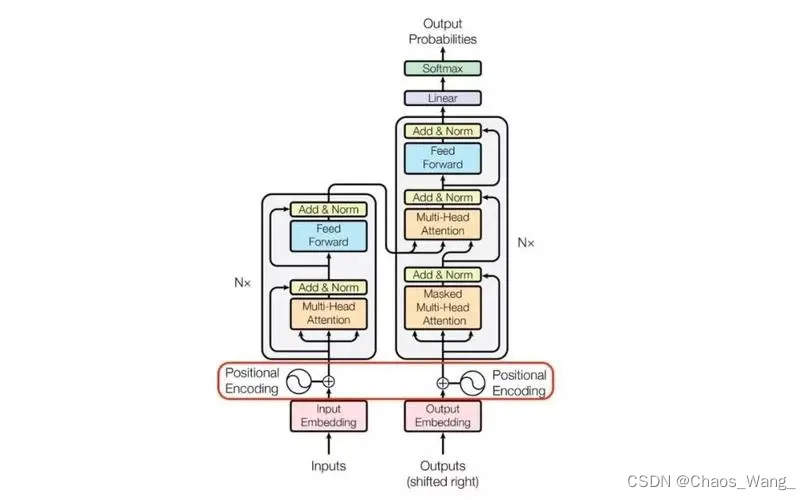
我们将HYDRA应用于校正后的MUSE感兴趣区域。简而言之,HYDRA旨在通过比较健康对照和LDD患者之间的模式来聚类疾病带来的影响,而不是直接聚类被试,从而产生从对照域到患者域的1到k映射。
与CHIMERA中使用的生成方法相比,HYDRA利用了广泛使用的鉴别方法,即支持向量机(SVM)来寻找这种“1到k”的映射。其新奇之处在于HYDRA以分段方式将多个线性支持向量机扩展到非线性空间,从而同时用于分类和聚类。具体来说,它将k个线性支持向量机的超平面结合起来,构造出凸多边形,分离CN和PT的k个子群。直观地说,凸多面体的每个面都可以被视为一个亚型,以捕捉不同的疾病效应。下面的示意图说明了HYDRA和半监督聚类的核心思想。HYDRA和半监督聚类的优点之一是, 它倾向于通过直接聚类健康对照和患者之间的差异来避免根据与疾病无关的混杂因素对患者进行聚类。

补图1:HYDAR(判别映射)原理图。
一般来说,HYDRA寻求一个相对同质的参考组(CN)和异质目标组的亚组(亚型)之间的“1到k”映射,因此,梳理出可能是由不同病理轨迹驱动的群,而不是由不相关的异质性驱动的群(如人口统计学或大脑老化)。
根据样本加权支持向量机的原理,将每个线性支持向量机作为子问题依次求解,从而估计出凸多边形。在每次迭代中,优化过程中只考虑患者样本的一个子群。直到样本权值稳定,即多边形稳定建立,优化过程才停止。多面体边界最大化的目标函数为:

其中wj 和bj分别代表每个超平面的权重和偏差。是训练误差的惩罚参数,S是维度为Nxk的亚型隶属度矩阵,其决定患者样本i是否属于亚型j。聚类成员隶属度计算公式如下:

我们使用校正后的Rand指数,选择最优维度或聚类数(k),其中2≤k≤8。另外,我们又评估了最优k聚类的鲁棒性。首先,考虑到两组患者在年龄、性别和站点上具有相似的队列特征,所以我们进行了拆分样本分析,以评估各个维度是否表现出相似的神经解剖模式。其次,我们进行了留一站点验证,以检验仅在UKBB上进行训练和在所有站点上进行训练,各个站点的维度是否一致。最后,采用置换检验对最优k聚类进行显著性检验(显著水平为0.05)。
神经影像、认知与遗传学的多维表征评估
随后,我们研究了GM体积、WM完整性、认知功能和抑郁相关变量以及遗传结构等多个维度的特征。此外,我们还研究了在一般总体和纵向总体中的k维表达。
GM的区域容积图
所有站点的GM区域容积图被用来评估GM体积的差异性。采用功能神经影像分析软件(AFNI17.2.10版)中的3dttest++,以年龄、性别、站点和颅内体积为协变量,识别相应维度与对照组的不同神经解剖模式。对校正后留下来的体素(Benjamini-Hochberg),进行配对比较以估计其体素效应大小图(即Cohen f2)。
WM的区域完整性异常
利用UKBB 48个区域束的平均各向异性分数值评估WM微结构是否异常。采用R3.4.0(R Foundation)的多元线性回归模型进行组间比较。年龄和性别为固定效应,组别为感兴趣变量。对P值进行校正,并计算Cohen f2。
人口统计学,认知和临床变量
各维度之间分别进行了人口统计学、认知和临床变量的组间比较(附录1中的eTable5)。连续变量(如年龄)采用Mann-Whitney U(Wilcoxon)检验,分类变量(如性别)采用χ2独立性检验。另外,对于连续变量也报道了全局效应量(即Cohen d)。
eTable 5: 维度1和维度2的人口统计学信息、诊断、临床和认知变量的比较

全基因组关联
我们使用PLINK 2.0(马萨诸塞州总医院)对衍生的二元维度特征(即维度1或维度2)与对照组进行全基因组关联。然后使用功能映射和注释(FUMA)在线平台1.3.6b(神经基因组学和认知研究中心)来标注基因组风险位点和显著的独立性单核苷酸变体。
一般人群的多维度评价
将训练后的模型应用于总体人群的验证样本(Table)。得到k个维度成员和表达分数。
另外,我们使用GM的区域容积图来检验神经解剖模式。此外,还研究了在一般人群中,k个维度的人口统计学和认知功能。并使用genome-wide Complex Trait Analysis软件1.93.2β计算了全基因组单核苷酸变体的遗传力系数(h2)。
纵向数据的多维度评估以及阿尔茨海默症和脑老化的患病进展
将使用横断面数据训练得到的模型应用于纵向数据(Table)。利用阿尔茨海默病识别指数和脑龄识别指数的萎缩空间模式,找到维度成员,并评估其在感兴趣的MUSE GM区域的纵向变化。具体来说,通过线性混合效应模型得出每个变量随时间的变化率,并使用线性回归模型进行跨维度的比较。
结果
HYDRA揭示的两个维度
k=2聚类HYDRA模型的校正后Rand指数最高(0.58)(eFigure 1)。k=2,3,…,8的聚类分配如eTable3。对于最佳聚类方案(k=2),227名LLD被分配到维度1,274名被分配到维度2。在分离样本和留一站点分析中复现了最优(k=2)聚类(eFigure 1)。在留一站点分析中,分配到相同维度的参与者的重叠率为446/501(89.02%)(UKBB 402/369[92%],BLSA 22/29[76%],BIOCARD 4/5[80%],UCSF 51/65[78%])。两个维度的神经解剖模式与原始维度模式(Figure 1)相似(eFigure 3)。在拆分样本分析中,与原始维度模式(Figure1)相比,两个拆分的GM模式相似(eFigure 2)。k=2时,校正后的Rand指数高于置换检验中的零分布(Cohen d, 0.31; 95%CI, 0.13-0.49; P<0.001)。最后,我们又给出了在没有排除UKBB共病的情况下的研究结果,这在2个维度上得到了类似的成像模式(eFigure4)。因此,后续我们给出了k=2时的所有分析结果。

eFigure 1:维数的聚类稳定性。绿色的圆点、红色的三角形、紫色的正方形和蓝色的星形分别代表原始实验、第一次和第二次拆分样本实验和留一站点(即UKBB训练)实验。

eFigure 2:在拆分样本分析中,与对照组相比,维度1和维度2中GM模式的效应大小图。暖色表示脑萎缩(即CN>Dim)和冷色代表体积较大的组织 (即:CN<Dim)。

eFigure 3:对于留一站点分析(仅在UKBB MUSE ROI上进行训练),与对照组相比,维度1和维度2中GM模式的效应大小图。暖色表示脑萎缩(即CN>Dim)和冷色代表体积较大的组织 (即:Dim>CN)。

eFigure 4:包括UKBB共病人群的两个维度。与对照组相比,在维度1和维度2中GM模式的效应大小图。暖色表示脑萎缩(即CN>Dim),冷色表示体积较大的组织(即Dim>CN)。
GM容积模式的差异
第1维度的患者双侧丘脑、壳核和尾状核的GM容积相对于健康对照个体更大。第2维度显示,与健康对照组相比,LDD的皮层区域GM容积普遍减小,包括双侧扣带回前、后、额回上、中、下、直回、岛叶皮质、颞上、中、下回(Figure1)。拆分样本和留一站点分析详细分别见eFigures 2和3。

Figure 1:与健康对照相比,分别在维度1和维度2中识别的效应大小图。
A、较暖的颜色表示脑萎缩(即NC>Dim),较冷的颜色表示体积较大的组织 (即Dim>NC)。每个维度都显示了两个方向。L:左;R:右。
B、维度1和2显示了基于分数各向异性值的2种不同的白质(WM)模式。第1维度患者表现正常,与健康对照无显著差异,而第2维度患者表现为WM完整性的广泛破坏。所有48个WM束的P值和效应大小见附录1的eTable4。两个方向都进行了比较,但效应大小只显示了WM完整性的破坏。Cohen f2值≥0.02、≥0.15、≥0.35分别表示小、中、大效应量。
eTable 4: WM的组间比较分析

WM完整性破坏的差异
患者在第1维度的各向异性分数值与健康对照相似。然而,在第2维度显示了WM的广泛破坏,且48个WM区域中有31个显著低于对照组,但效应值较小(0.01≤Cohen f2≤0.05, Figure 1B)。具体来说,小脑中脚束达到了最高的效应量(Cohen f2=0.05)。其他受累的脑白质束主要累及额叶和皮层下边缘区(eTable4)。
不同维度的临床表现差异
第1维度的患者流体智力得分较高(Cohen d, 0.25;95% CI, 0.09-0.41),成对匹配检验误差较小(Cohen d, -0.28;95%CI, -0.41~-0.15),患者健康问卷应答中抑郁症状更少(Cohen d, -0.45;95%CI, -0.95~0.05)。这两个维度在年龄、性别、站点或其他临床变量上没有显著差异(eTable 5)。
eTable 5: Dim1和Dim2的人口学、诊断、临床和认知变量的比较


全基因组关联的差异
维度1与1个新的独立变体(rs13120336;染色体:4,186387714;次等位基因,G)(优势比,2.35;SE, 0.15;P=3.14×108)(Figure 2)。分位数图见eFigure 5。

Figure2:
A、维度1与1个新的基因组风险位点显著相关。该显著的独立单核苷酸变异(SNV)(rs13120336)与其他7个通过GWAS P值(阈值5e-8)的候选SNV连接不平衡。功能图谱和标注鉴定出2个相应的蛋白编码基因:CCDC110和LOC105377590。
B、第2维度与任何变异均无显著相关。
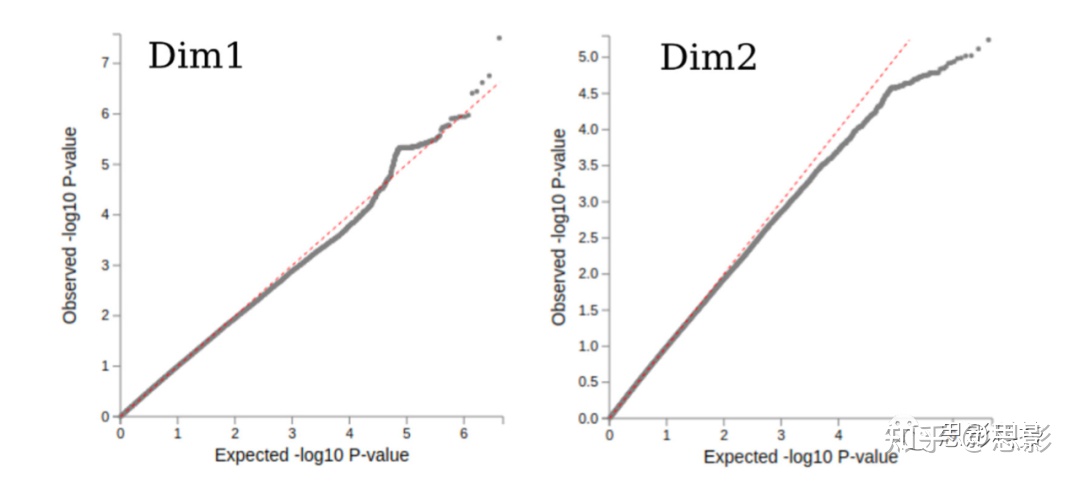
eFigure 5:与CN相比,GWAS分别在Dim和Dim2中的Q-Q(quantile-quantile)曲线图。Q-Q图采用真实的GWAS p值,按升序排序,然后将它们与根据理论均匀分布计算的分位数作图。Q-Q图显示,观察到的统计量因样本量小而不足。
2个维度在一般人群中的表达
将训练后的模型应用于UKBB样本,其中2269名参与者在维度1表达、3786名参与者在维度2表达、2963名参与者同时表达了两个维度,以及3500名参与者没有任何维度表达(eTable 6;Figure 3)。
eTable 6:UKBB验证样本中维度1和维度2的人口学、诊断、临床和认知变量的比较。


Figure3:
A、UKBB的2个神经解剖学维度显示了显著的灰质(GM)异常。分别在第1维度和第2维度的GM模式的效应大小图。较暖的颜色表示脑萎缩(即none>Dim),较冷的颜色表示体积较大的组织(即none<Dim)。Cohen f2≥0.02、≥0.15、≥0.35分别表示小、中、大效应量。我们将年龄、性别和颅内体积作为固定效应,将分组(none vs dimension 1或dimension 2)作为感兴趣的变量。各效应采用似然比检验。
B、通过对晚年抑郁症人群进行训练的判别分析模型将异质性应用于外部UKBB个体后的象限图。x轴和y轴分别表示每个个体在第1维度和第2维度的表达得分。维度成员由2个表达得分E1和E2决定。其中E1、E2<-0.3时为none,E1<0.3、E2<-0.3时为维度1,E1<-0.3、E2>0.3时为维度2,其他个体为混合维度。
两个维度的神经解剖模式是稳定的(Figure 3)。维度1的参与者流体智力得分更高(Cohen d, 0.28;95%CI,0.22~0.34;P<0.001),但成对匹配的误差更低(Cohen d,−0.13;95% CI,−0.18~−0.08;P<0.001)(eTable 6)。2个维度的表达得分在一般人群中具有显著的遗传性。具体地说,维度1的h2为0.27(SE, 0.04;P<0.001),维度2的h2为0.18(SE, 0.04;P<0.001)。
2个维度和纵向轨迹
将训练后的模型应用于ADNI、BLSA和BIOCARD(也有纵向随访数据),得到301名参与者在维度1表达了,1390名参与者在维度2表达了,2330名参与者在2个维度都表达了,410名参与者在基线时两个维度都没有表达(eTable 7)。2个维度的神经解剖形态稳定(eFigure 6)。在第2维度,尤其是左中央前回、颞极和右岛叶前部(eFigure 6),GM的变化速度比第1维度或非第1维度下降更快(-0.1 < Cohen f2 < 0.1)。此外,两个维度在纵向轨迹上均保持了独立性和稳定性(Figure 4)。与第1维度(Figure 4B)相比,第2维度的患者在阿尔茨海默病认知(Cohen f2=0.03)和脑萎缩识别的萎缩空间模式(Cohen f2=0.03)方面均有进展,但在基线时没有。
eTable 7:ADNI、BLSA和BIOCARD纵向数据集的人口学和维度信息


eFigure 6:两个维度和纵向轨迹。
A) ADNI、BLSA和BIOCARD基线时两个神经解剖学维度均显示了明显的灰质异常。较暖的颜色表示脑萎缩(即None>Dim),较冷的颜色表示较大的体积(即Dim>None)。
B)变化速率(RC)表明,维度1的脑容量随时间的减少比维度2更快。

Figure 4:A、将差异分析(HYDRA)模型的异质性应用于所有可用的纵向扫描数据,随访时间至少6年。这两个维度随着时间的推移保持稳定,并且彼此独立。B、阿尔茨海默病认知(SPARE-AD)和脑萎缩识别的萎缩空间模式(SPARE-BA)的第2维度变化阳性率均大于第1维度,说明第2维度患者在纵向上更容易发展成为阿尔茨海默病和脑老化。
讨论
两个可重现且不同的维度表征了LLD(老年抑郁症)患者的神经解剖异质性。维度1的患者的大脑解剖结构保存相对较好,皮质下区域体积较大,并且更有可能具有1个新基因变异,而维度2的患者表现出广泛的脑萎缩和WM完整性被破坏,伴有认知功能受损和抑郁严重程度增加。此外,这两个维度在一般人群中都有表现并且具有显著的遗传性。值得注意的是,与维度1相比,维度2的患者表现出更高程度的AD进展和脑老化特征。
这两个维度显示了LLD患者潜在GM异质性的程度。在先前的病例对照研究中,已广泛报道了在维度2中GM的明显萎缩。已经观察到额叶的区域性萎缩,这与认知缺陷以及精神病症状的报告有关。尽管在UKBB抑郁表型中发现了尾状核和壳核体积的增加,但纹状体萎缩与尾状核和参与情绪调节的皮质边缘区域之间的多巴胺连接退化有关。维度2显示海马区萎缩,这可能预示着未来与阿尔茨海默病相关神经的进行性退化。
2个确定的神经解剖学维度在微观结构完整性方面存在显著差异。维度1无明显的WM异常,而维度2显示广泛的WM异常。WM病变可能在赋予LLD患者易感性或使抑郁综合症持续存在并导致观察到的微观结构紊乱方面发挥关键作用。在LLD患者中,广泛的WM破坏可能持续存在,甚至将WM病变从扩散张量成像分析中排除。连接额皮质下和前边缘区域的WM束最常受到影响,包括钩束、前丘脑辐射、上纵束和后扣带皮层。维度2展示了LLD患者的临床特征,这些特征通常与更严重的认知退化相关。有趣的是,先前使用抑郁症状和认知评分或代谢-炎症谱的研究得出了1个亚型,即健康组和其他表现出更高抑郁症状评分或更特异的免疫-炎症失调谱。
检测到的遗传变异(rs13120336)仅与维度1相关。两个定位的基因(CCDC110和LOC105377590)先前已经被证实与癌症和糖尿病有关。我们推测这些遗传因素可能在二维影像表型和认知功能障碍的异质性中起关键作用。大量研究表明,抑郁症与不同的基因变异有关,其中一些基因变异无法复制,需要进行复制以确认此检测到的变体。总的来说,我们的维度表征可能为研究抑郁症基因关联提供了另一种方法。
这两个维度显示出了18%~27%的显著遗传力,这可能代表了在一般人群中与抑郁症相关的神经解剖表型的遗传基础。UKBB的患病人群,例如精神分裂症和焦虑症,有可能解释了这两个维度的部分表达。重度抑郁症是一种常见且复杂的综合症,其遗传率约为40%,患病率在7%~13%之间。我们的研究结果证实了抑郁症在普通人群中的高风险和高患病率。
本研究中提出的二维表示突出了区分与神经退行性疾病同时或先于神经退行性疾病发生的LLD的预后潜力。维度2的患者更大可能发展为阿尔茨海默病或加速脑老化,而维度1的患者的大脑解剖结构保存的较好。流行病学研究一致发现,阿尔茨海默病和LLD存在共同的风险因素,这一发现支持了抑郁症作为前驱特征或与阿尔茨海默病相关的风险因素。这两个维度在认知损伤上没有纵向差异,这可能支持了阿尔茨海默病的病理级联模型。
为了确保研究结果的可复现性,我们进行了拆分样本分析、留一站点分析,并将使用LLD训练的模型应用于独立的UKBB数据集以及与LLD年龄范围相同的ADNI、BLSA和BIOCARD组合队列。从技术角度来看,将经过训练的LLD模型应用于年轻人群是可行的,但可能因为年龄范围的显著差异,而不是感兴趣的疾病效应使模型得到无效解(因为衰老可能在驱动这些维度方面发挥关键作用)。我们认为,将该模型应用于外部数据需要仔细考虑潜在的混淆因素,如人口统计学差异等。
局限性
本研究也有许多局限性。首先,需要LLD中的纵向数据来确定所提出的多维表示的附加值。此外,当有额外的数据可用时,需要复现全基因组关联结果。
结论
在这项研究中,LLD(老年抑郁症)被分为与神经解剖学、认知功能和基因图谱相关的两个维度。二维表达为研究潜在的病因机制、遗传结构的异质性以及个性化临床护理提供了新方向。
文献名:Characterizing Heterogeneity in Neuroimaging, Cognition,Clinical Symptoms, and Genetics Among Patients With Late-Life Depression.