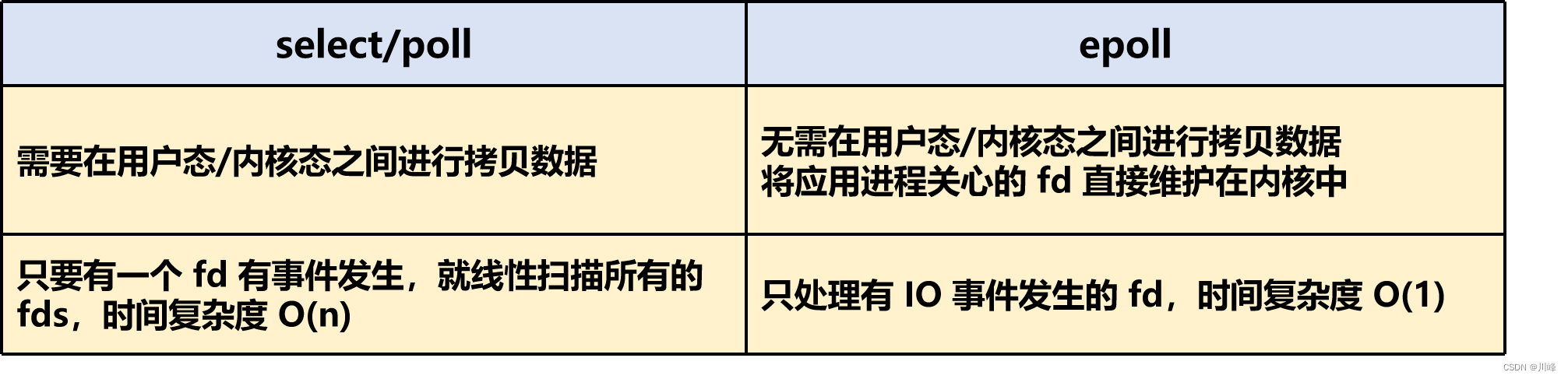
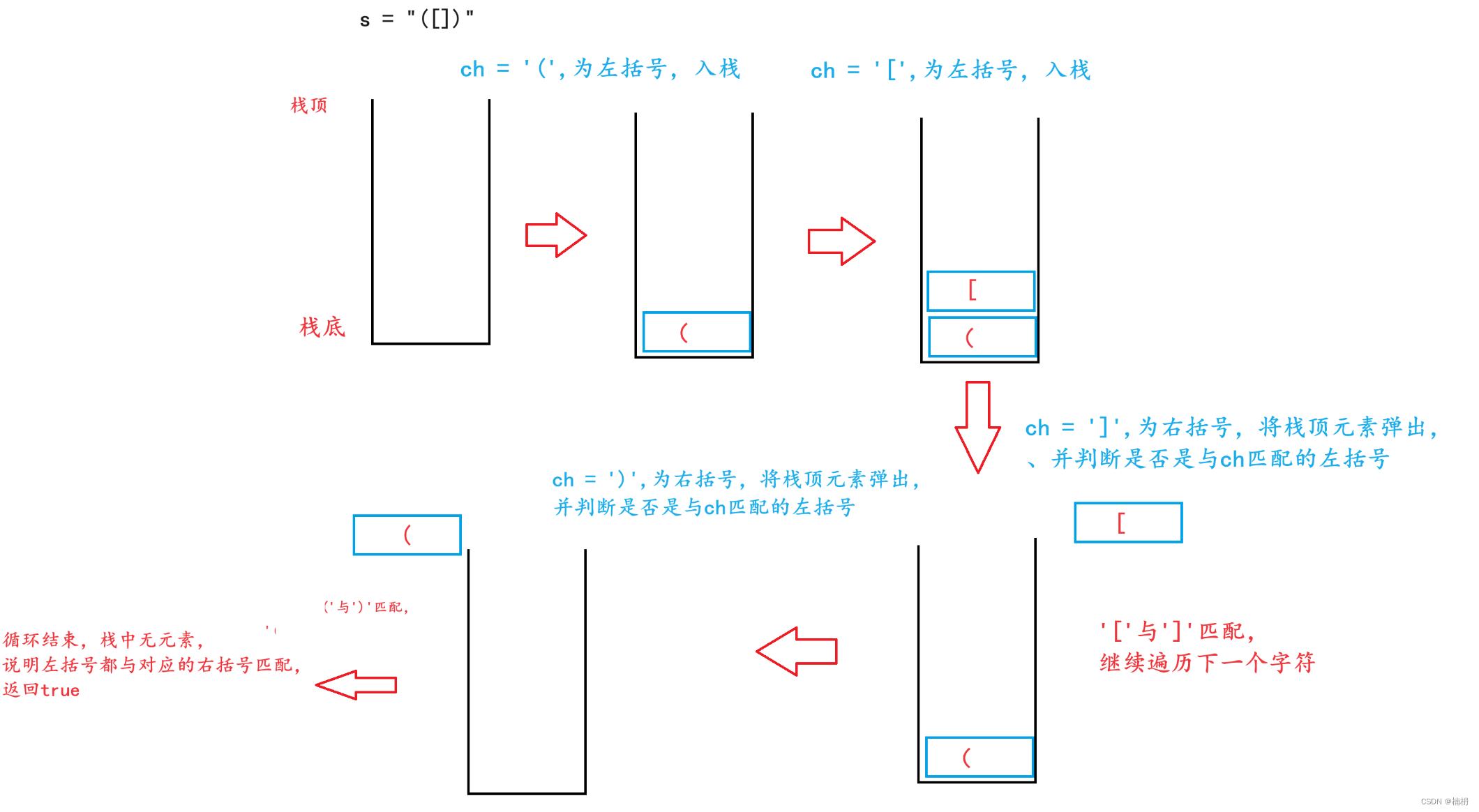
溶质载体家族31成员1(SLC31A1)最近被确认为铜死亡的细胞死亡调控基因。最新研究表明,SLC31A1可能在结直肠癌和肺癌的肿瘤发生中发挥作用。然而,SLC31A1及其在多种肿瘤类型中的铜死亡细胞死亡调控功能的作用仍需进一步阐明。
1.SLC31A1在各种组织和肿瘤中的表达
根据HPA、GTEx和FANTOM5的数据集(对哺乳动物基因组的功能注释),发现SLC31A1在许多组织中广泛表达,包括肝脏、胆囊、胃肠道(如小肠和十二指肠)(图1a)。图1b中的蛋白质表达谱显示,SLC31A1在海马、肺、子宫内膜和肾脏中表达较高,在食道、前列腺和皮肤中表达较低。此外,单细胞RNA测序分析显示,在前列腺腺体细胞、浆液腺细胞和肝细胞中SLC31A1表达高。还注意到SLC31A1在巨噬细胞中也高度表达。
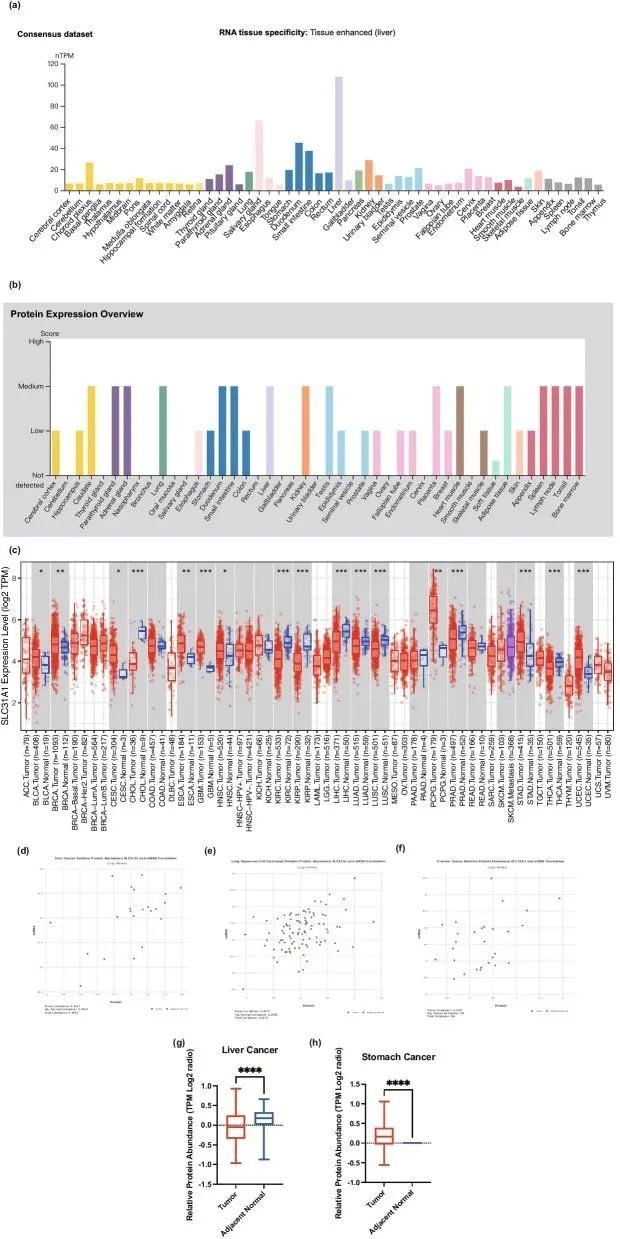
图1 SLC31A1在正常组织和不同肿瘤中的表达
作者进一步研究了SLC31A1在肿瘤组织中的表达模式。与相应的正常组织相比,大多数肿瘤组织中SLC31A1 mRNA的表达增加了(图1c)。与相应的正常组织相比,乳腺浸润性癌(BRCA)、食管癌(ESCA)、嗜铬细胞瘤、副神经节瘤(PCPG)、胶质母细胞瘤(GBM)、胃腺癌(STAD)和子宫体内膜样癌(UCEC)的肿瘤组织SLC31A1的表达水平较高(所有P < 0.01)。相反,在胆管癌(CHOL)、肾嗜铬细胞瘤(KIRC)、肾透明细胞癌(KIRP)、肝细胞癌(LIHC)、肺腺癌(LUAD)、肺鳞状细胞癌(LUSC)、前列腺腺癌(PRAD)和甲状腺癌(THCA)的肿瘤组织中观察到SLC31A1 mRNA表达水平降低(P < 0.001)。在一些肿瘤类型中,如胰腺腺癌(PAAD)和子宫肉瘤(UCS),SLC31A1的表达没有显著变化。
作者随后评估了改变的mRNA表达对SLC31A1蛋白的可能影响。图1d-f显示了来自cProSite的相对蛋白丰度数据,显示在肝癌、肺鳞状细胞癌和卵巢癌中,SLC31A1蛋白的表达水平与mRNA呈中度正相关。此外,肝癌和胃癌中SLC31A1蛋白的相对丰度在肿瘤组织和相邻正常组织之间显示出显著差异(P < 0.0001)(图1g,h),与mRNA表达差异一致。这些结果进一步确认了异常的SLC31A1表达可能参与多种癌症。
2.SLC31A1表达与癌症预后的关联
基于TCGA数据集,使用GEPIA2研究了SLC31A1表达与不同肿瘤类型的预后之间的相关性。结果显示,在肾上腺皮质癌(ACC)(P = 0.0012)、乳腺癌(BRCA)(P = 0.0027)、间皮瘤(MESO)(P = 1.8 × 10 –5 )、皮肤黑色素瘤(SKCM)(P = 0.027)、低级胶质瘤(LGG)(P = 0.00012)、睾丸生殖细胞肿瘤(TGCT)(P = 0.05)和胸腺瘤(THYM)(P = 0.038)中,SLC31A1表达水平较高与较差的总生存期(OS)相关,而在肾透明细胞癌(KIRC)(P = 3.5 × 10 –5 )中,SLC31A1表达水平较低与较差的5年生存期相关(图2)。此外,DFS分析显示,如果ACC(P = 7 × 10 –4 )、LGG(P = 0.032)和MESO(P = 0.044)患者的SLC31A1水平较高,其预后较差,而KIRC(P = 6.7 × 10 –6 )和胃腺癌(STAD)(P = 0.02)患者的SLC31A1水平较低(图3)。根据结果,异常的SLC31A1表达与多种肿瘤类型的不良预后相关。
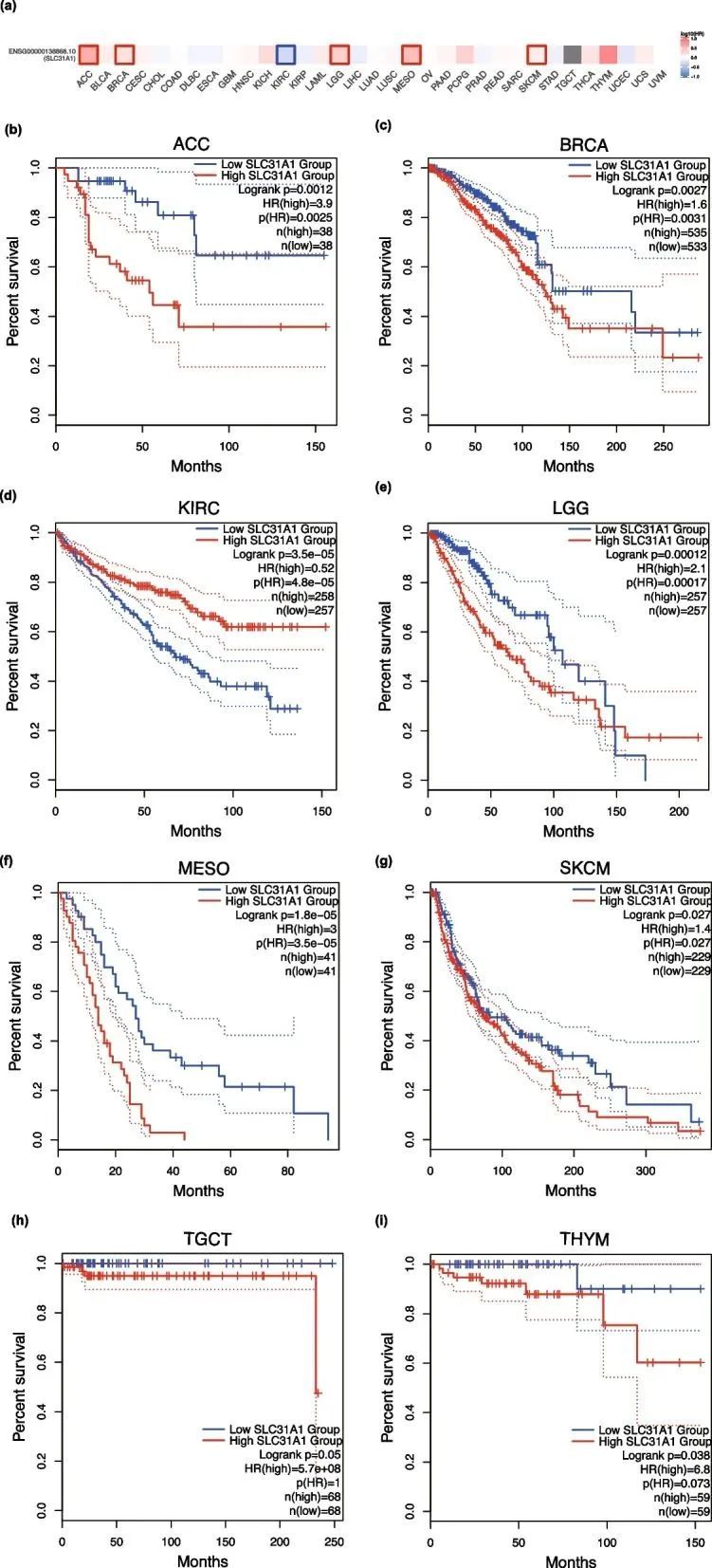
图2 SLC31A1表达对不同TCGA肿瘤类型的总生存期的影响

图3 SLC31A1表达对不同TCGA肿瘤类型的无病生存影响
此外,作者使用GEPIA2来研究SLC31A1表达与肿瘤的病理分期之间的关联,并发现在ACC、KIRC和MESO的病理分期中,SLC31A1的表达存在显著差异(所有P < 0.05)。
3.肿瘤中的SLC31A1基因变异
CBioPortal随后被用于检查TCGA数据集中各种肿瘤类型中SLC31A1基因的变异情况。发现UCEC的肿瘤样本具有最高的SLC31A1基因变异频率(2.46%)。在ACC的肿瘤样本中,所有的SLC31A1突变都是拷贝数扩增的(图4a),这在TCGA的所有肿瘤样本中是SLC31A1最常见的遗传变异。除了UCEC和ACC,SLC31A1的遗传变异还观察到在超过1%的膀胱尿路上皮癌(BLCA)、前列腺腺癌、肉瘤和肾脏乳头状细胞癌中。如图4b所示,TCGA肿瘤样本中包含了总共27个SLC31A1突变,包括23个错义突变、一个融合突变、两个移码突变和一个起始密码子突变。根据TCGA肿瘤样本,S105Y是SLC31A1中最常见的点突变(图4b)。在ICGC数据库中,突变S105Y也是SLC31A1中最常见的突变。

图4 TCGA中各种肿瘤类型中的SLC31A1基因改变
此外,通过使用OncoVar和COSMIC的数据库,使用AI-driver方法,S105Y被确定为一个潜在的驱动突变,其OncoVar分数为0.998。
4.SLC31A1表达与免疫浸润之间的相关性
肿瘤的免疫浸润可能会影响预后和治疗。作者使用TIMER2算法探索了SLC31A1在多种肿瘤中21种免疫浸润的相关性,包括TIMER、xCell、MCP-counter、CIBERSORT、EPIC和quanTIseq(图5)。值得注意的是,SLC31A1与多种肿瘤中的巨噬细胞浸润呈正相关,包括BLCA、COAD、HNSC、KIRC、LUAD、LUSC、PAAD和THYM。SLC31A1与BLCA、COAD和STAD中的中性粒细胞浸润呈正相关。这些发现表明SLC31A1在癌症发展和进展过程中在免疫过程中可能发挥潜在作用。

图5
此外,来自HPA数据库的免疫组化分析证实了HCC组织中KPNA2、LAGE3、SF3B4、CCT3和GTPBP4蛋白表达较高,而CYP2C9和PON1蛋白表达较低(图7D-J)。
5.SLC31A1相关基因在代谢途径中的丰富程度
使用GEPIA2从TCGA中提取与SLC31A1在所有肿瘤类型中具有相似表达模式的前100个基因,以研究该基因的功能影响。GO和KEGG富集分析表明这些基因参与代谢途径和内质网中的蛋白质加工(图6a-d)。这些发现使作者想知道SLC31A1是否通过与蛋白质结合、细胞膜的完整组分、代谢途径和内质网中的蛋白质加工相关的关键蛋白质相互作用来参与这些生物过程。图6e显示了在BioGRID中进行的PPI网络(最小证据=1)。根据Wikipathways注释,铜稳态途径中的三个基因,包括超氧化物歧化酶铜伴侣蛋白(CCS)、磷脂酰肌醇-4,5-双磷酸3-激酶催化亚基α(PIK3CA)和溶质载体家族31成员2(SLC31A2),在PPI网络中作为节点被发现[32]。此外,SLC31A2、PIK3CA和CCS的表达水平与SCL31A1呈相关性(图6f,g)(Spearman r = 0.31,0.分别为34和-0.22。
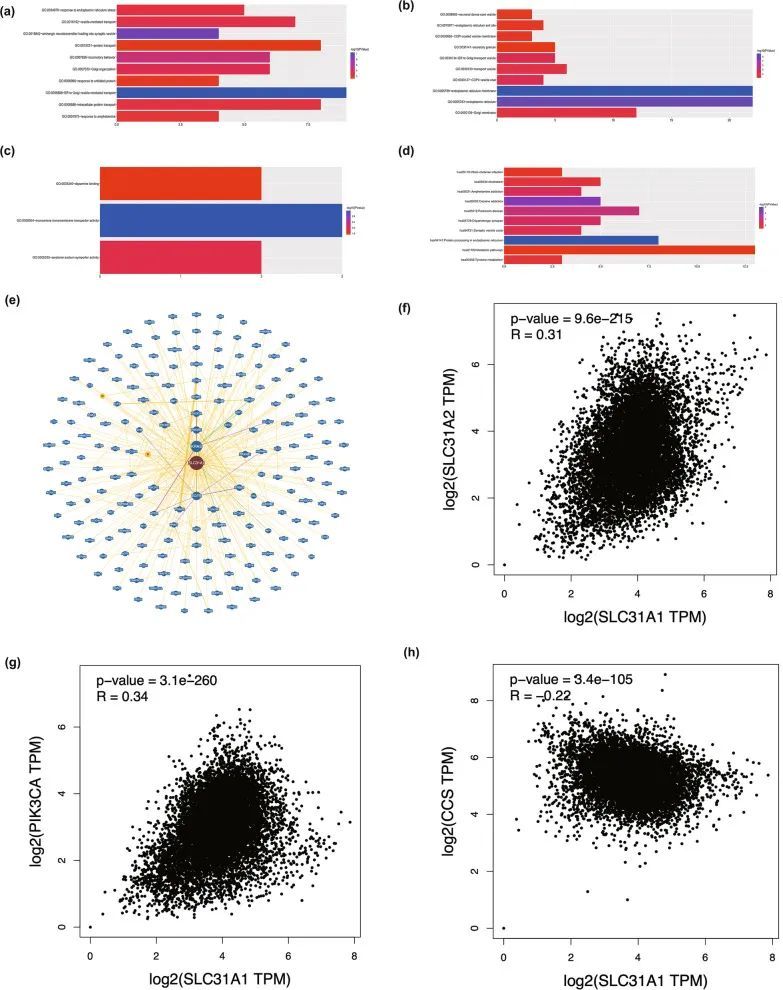
图6 SLC31A1相关基因富集分析
总结
作者的全癌症分析表明,铜死亡调控基因SLC31A1在多种癌症中发生了失调,其表达和遗传改变与这些肿瘤患者的临床结果相关。此外,免疫浸润分析和基因富集分析为了解与SLC31A1在癌症中相关的潜在机制提供了新的见解。因此,作者的研究需要进一步的实验和临床研究,以了解SLC31A1的功能及其在癌症治疗和预后预测中的潜在实际应用。