生物体的生存完全依赖于它们对基因组完整性的维持,而基因组完整性受到增殖细胞复制胁迫的永久威胁。尽管植物DNA损伤反应(DDR)调节因子SOG1已被证明能够应对复制缺陷,但越来越多的证据表明,还有其他途径独立于SOG1发挥作用。
2023年7月5日,巴黎萨克雷大学的Cécile Raynaud研究团队在 Molecular Plant期刊发表了题为“Distinctive and complementary roles of E2F transcription factors during plant replication stress responses”的研究论文。该研究揭示了拟南芥E2FA和E2FB转录因子在DNA复制胁迫响应中的作用。

研究单位:法国巴黎萨克雷大学
发表时间:2023年7月5日
发表杂志:Molecular Plant (IF:27.5)
研究技术:TChAP、ChIP-seq、RNA-seq
01 研究背景
在所有真核生物中,遗传信息从一代到下一代的忠实传递在很大程度上依赖于准确的DNA复制。一些因素,包括嘧啶二聚体,未修复的DNA损伤,RNA-DNA杂交和DNA二级结构的形成,可以破坏或减缓DNA复制。这些因素可能导致分叉停滞,导致复制胁迫,进而影响基因组完整性。
02 研究思路
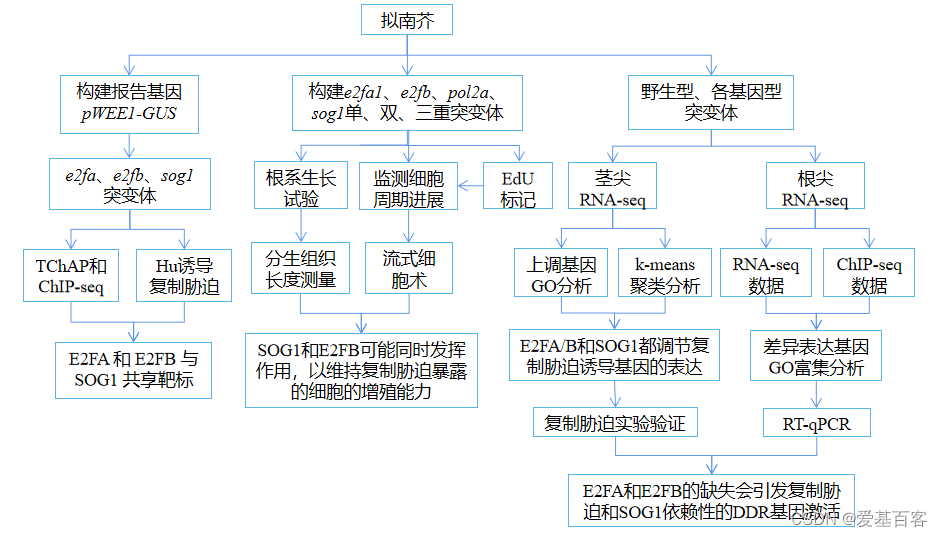
03 研究结果
1. E2FA 和 E2FB 与 SOG1 共享靶标
E2FA、E2FB和RBR1最近都被证明在植物的DNA双链断裂(DSB)反应中发挥作用。利用最近对E2FA和E2FB靶标的分析,作者研究了E2FA/B是否与SOG1有共同的靶标。
通过串联染色质亲和纯化(TChAP)或染色质免疫共沉淀测序(ChIP-seq)实验确定的E2FA、E2FB和SOG1的靶基因时,作者发现,与偶然预期相比,两个E2F转录因子中的至少一个也靶向了更多的SOG1靶基因(图1A)。其中,WEE1基因编码一种参与复制胁迫反应的细胞周期抑制激酶。有趣的是,在sog1突变体中,在羟基尿素(HU)诱导的复制胁迫反应中观察到WEE1启动子的残余激活,并且在其启动子中发现E2F结合位点,这证实了E2FA/B可能参与复制胁迫反应。
接下来,作者将实验确定的E2FA和E2FB结合位点的位置与之前确定的SOG1结合位点的位置进行了比较。E2FA和E2FB均在靠近SOG1结合位点的位置结合共同靶基因(图1B-E),表明E2FA/B和SOG1在其靶启动子上彼此紧密结合。观察到E2FA/B可以独立于SOG1激活WEE1以响应HU,并且推测的E2FA/B和SOG1靶基因之间的显著重叠(图1A)促使作者检验E2FA/B是否在复制胁迫反应中发挥作用。

图1. E2FA、E2FB和SOG1具有共同的靶基因
2. E2FB的缺失严重加剧了由复制胁迫引发的生长缺陷
为了探索E2FA和E2FB在复制胁迫反应中的作用,作者使用了表现出组成型复制胁迫的DNA聚合酶ε(Polε)的亚型突变体pol2a-4(以下简称pol2a),并在pol2a、sog1和e2fa或e2fb突变体之间产生双重突变体和三重突变体组合。E2FA和E2FB都有两个独立的T-DNA插入系。就E2FA而言,e2fa-1等位基因似乎是一个缺乏E2FA蛋白积累的无效突变体,而e2fa-2则积累了大量截短蛋白。就E2FB而言,在e2fb-1或e2fb-2突变体的蛋白提取物中均检测不到该蛋白。在蛋白质功能方面,利用e2fa-2而非e2fa1等位基因获得了可存活的的e2fa e2fb双突变体,这表明在e2fa-2突变体中积累的截短蛋白质至少具有部分功能。因此,在遗传分析中,作者只使用了e2fa1突变等位基因(其中E2FA可能完全丧失功能)和e2fb两个等位基因。
表型上,与野生型(Col0)相比,e2fa-1和e2fb-1单突变体没有表现出生长减少,而pol2a突变体明显较小(图2A,B),pol2a sog1双突变体的生长减少更为严重,与sog1突变体对复制胁迫的超敏感性一致,pol2a e2fa-1突变体的莲座大小与pol2a亲本相同,而e2fb-1 pol2a突变体的莲座略小。值得注意的是,e2fb-1 pol2a sog1三突变体比pol2a sog1表现出更严重的生长缺陷,而e2fa-1突变体没有观察到这种现象(图2A,B)。作者还分析了各种突变体的根长,并观察到E2FB,而非E2FA,是遭受组成性复制胁迫的植物根系生长所必需的(图2C),特别是在SOG1缺失的情况下。这些数据表明,E2FB有助于植物对复制胁迫的反应,尽管存在复制缺陷,但仍能维持生长。

图2. E2FB,而非E2FA是植物持续生长所必需的,以响应复制胁迫
3. E2FB正向调节分生组织大小和细胞周期进程以响应复制胁迫
在e2fb-1 pol2a sog1三重突变体中观察到的严重生长抑制,以及在e2fb-1 pol2a双突变体中的较小程度的生长抑制,可能是由于细胞增殖缺陷所致。为了验证这一假设,作者首先测量了所有基因型的根分生组织的大小。如图3所示,Polε缺失引发的复制胁迫导致分生组织大小减小。虽然这一缺陷在SOG1缺失的情况下并没有显著加剧,但在ef2b-1 pol2a和e2fb-1 pol2a sog1突变体中,根分生组织长度进一步缩短(图3B)。同样,在e2fa-1 pol2a和e2fa-1 pol2a sog1突变体中没有观察到这种影响。这些结果证实,E2FB而非E2FA在细胞增殖中发挥关键作用,以保护它们免受复制胁迫引发的细胞增殖停滞。

图3. 在pol2a背景中,E2FB的丢失进一步减少了根尖分生组织的长度
为了进一步剖析E2FB如何影响细胞增殖以应对复制胁迫,作者对所有突变体组合的细胞周期进展进行了更详细的分析。作者首先分析了花蕾中细胞核的细胞周期阶段分布,在野生型、sog1、e2fb-1单突变体和e2fb-1 sog1双突变体中,各细胞周期阶段的细胞核比例相同(图4A)。在所有含有pol2a的突变组合中,S期细胞的比例都增加了,这与作者之前的发现一致。此外,作者观察到,与pol2a和pol2a sog1突变体相比,e2fb-1pol2a和e2fb-1pol2a sog1突变体中G2核的比例增加,而G1核的比例下降(图4A)。在e2fa-1突变体组合中没有观察到这种现象。这些数据表明,E2FB对暴露于复制胁迫的细胞通过G2的细胞周期进展和G2/M过渡的开始起着积极的调节作用。
作者接下来对四天龄的幼苗进行了乙炔基-2’-脱氧尿苷(EdU)的累积标记。在pol2a sog1 e2fb-1三重突变体中,EdU的掺入极其缓慢,这使得很难像前面描述的那样可靠地估计细胞周期或S期长度。作为替代方案,作者计算了施用EdU 5h后显示EdU标记的有丝分裂的根的比例,以监测不同突变组合对S和G2进展的影响。正如预期的那样,与野生型相比,pol2a突变体中标记有丝分裂的比例减少,而sog1、e2fb-1或e2fb-1 sog1突变体中标记有丝分裂的比例不变(图4B)。此外,e2fb-1pol2a 双突变体和e2fb-1pol2a sog1三重突变体分别比pol2a和pol2a sog1突变体显示更低的标记有丝分裂百分比(图4B)。综上所述,这些结果证实了在复制胁迫下,E2FB是细胞周期进展到G2所必需的,并且在没有SOG1的情况下,这一功能尤其重要,这表明SOG1和E2FB可能同时发挥作用,以维持复制胁迫暴露的细胞的增殖能力。

图4. 复制胁迫反应中E2FB正向调节G2/M进程
4. E2FB和SOG1都调节复制胁迫诱导基因的表达
为了深入了解E2FB在复制胁迫反应中的作用机制,作者比较了pol2a、pol2a sog1和e2fb1 pol2a sog1突变体茎尖的基因表达的变化。与野生型植株相比,在pol2a、pol2a sog1和e2fb-1 pol2a sog1突变体中分别发现了1822、2599和3512个上调基因。其中,1095个基因在所有三个突变系中普遍上调(图5A)。对这1095个基因进行GO分析显示,DNA修复、DNA复制和细胞周期负调控等GO terms显著富集(图5B),这与POL2A缺乏引发的组成型复制胁迫和诱导的细胞周期缺陷一致。正如预期的那样,在e2fb-1 pol2a sog1突变体中特异性上调的基因在E2F靶基因中并不富集,这表明它们中的大多数可能是由E2Fs间接调控的。
为了了解SOG1靶基因在不同基因型中的行为,作者对pol2a、pol2a sog1和e2fb-1 pol2a sog1突变体中SOG1靶基因的表达水平进行了k-means聚类分析(图5C)。在309个SOG1靶基因中,有78个靶基因在至少一个基因型中与野生型相比显著上调,并被保留在分析中。这种方法揭示了六个表现出不同表达谱的基因簇,簇1中的基因似乎只受SOG1控制,因为它们在pol2a突变体中上调,而在pol2a sog1或e2fb-1 pol2a sog1突变体中不上调,并且不富集在 E2F靶标中。相反,簇3中的基因主要受e2fb-1突变的影响,因为它们在pol2a和pol2a sog1突变体中仅轻微上调,而在三重突变体中则非常强烈上调。其余簇中的基因则同时受到E2FB和SOG1的影响。簇4和簇5包含在所有三个突变系中上调的基因,尽管这种诱导在sog1突变背景中不那么明显。其中,一些在pol2a sog1和e2fb-1 pol2a sog1突变体中的表达水平相似,而另一些在缺乏E2FB的情况下表达上调。同样,与pol2a单突变体相比,簇2基因在pol2a sog1突变体中表达水平下调,而在三重突变体中表达水平升高,表明这些SOG1靶基因受到E2FB和SOG1的拮抗控制。有趣的是,簇2、簇4 和簇5在E2F靶标中特别丰富,进一步支持了它们受SOG1和E2FB双重控制的假设。事实上,与pol2a sog1突变体相比,e2fb-1 pol2a sog1三重突变体中上调的基因明显富集了SOG1靶标(图5D),这进一步证实了真正的SOG1靶点可以独立于SOG1被激活以响应复制胁迫。
在似乎受SOG1和E2FB拮抗控制的共用E2FB/SOG靶标中,作者发现ANAC044和ANAC085转录因子基因(分别位于簇4和簇2中)已被证明负调控G2/M进展,RT-qPCR证实了这一结果。有趣的是,ANAC044和ANAC085不仅是SOG1和E2FB的直接靶标,也是RBR1的靶标,这表明E2FB可通过与RBR1的相互作用抑制它们。
综上所述,作者的转录学结果表明,SOG1和E2FB对它们的共同靶标大多具有拮抗作用,E2FB可能在缓解SOG1诱导的细胞周期停滞基因的诱导方面发挥重要作用。有趣的是,与野生型植株相比,在pol2a sog1和e2fb-1pol2a sog1突变体中特异性上调而在pol2a单突变体中没有上调的所有基因的GO分析表明,与细胞周期调控相关的基因显著富集。此外,E2FA和E2FB靶标在该列表中也显著富集。值得注意的是,E2F靶标在所有三个突变系中普遍上调的基因中也高度富集。这些结果共同表明,其他E2Fs,尤其是E2FA,可能参与了这些基因的调控。

图5. E2FB和SOG1协同控制复制胁迫诱导的转录变化
5. E2FA、E2FB和SOG1协同作用,允许细胞周期进程以响应复制胁迫
为了检验E2FA在缺乏E2FB和SOG1的情况下是否有助于参与复制胁迫响应,作者使用了E2FA的部分功能丧失等位基因(e2fa-2),并产生了e2fa-2 e2fb-1 sog1三重突变体。为了诱导复制胁迫,将试管苗暴露于复制抑制剂HU。正如之前发表的那样,sog1突变体对复制胁迫略微敏感,而e2fa、e2fb和e2fa-2 e2fb-1则没有表现出这种超敏反应(图6)。e2fa和e2fb突变等位基因的表现相同。同样,在对pol2a突变体诱导的组成型复制胁迫的反应中(图2B),e2fb-1 sog1而非e2fa-1 sog1双突变体对HU比sog1突变体更敏感,这与E2FB在复制胁迫反应中的作用比E2FA更显著的假设一致。值得注意的是,e2fa-2 e2fb-1 sog1三重突变体表现出更强的HU超敏反应,转移到HU上后根的生长几乎完全受阻(图6),根分生组织中的细胞死亡被诱导,这揭示了在E2FB和SOG1失活时E2FA对复制胁迫反应的贡献。

图6. E2FA、E2FB和SOG1的同时缺失使植物丧失了耐受复制胁迫的能力
最后,由于在S期分叉进程受阻是不可避免的,作者研究了E2F缺乏是否会在野生型背景下引发复制胁迫。事实上,e2fa-2 e2fb-1双突变体(而非单突变体)表现出根分生组织大小减小和细胞增殖略有减少。虽然这种表型可能是由于E2Fs作为细胞周期进展激活剂的作用,但它也可能反映了对S期通常发生的基础水平复制胁迫的低效反应。与这一假设相符,作者发现e2fa-2 e2fb-1双突变体的S期延长,细胞周期总长度增加(图7)。重要的是,这些缺陷被sog1突变消除,表明E2F缺乏会引发复制胁迫,导致SOG1依赖性细胞周期延迟。

图7. E2F缺乏触发复制胁迫和SOG1依赖的细胞周期延迟
为了证实这一假设,作者对在对照条件下生长的7日龄幼苗的根尖进行了RNA-Seq分析。在e2fa-2 e2fb-1突变体中,共发现148个基因下调,根据ChIP数据,其中73个基因可能是直接的E2FA或E2FB靶基因(图8A)。该列表包括DNA复制机制的描述组件和GO富集类别,包括DNA复制起始,DNA双链解离和染色质组装。除了148个下调基因外,作者还发现345个基因上调,根据ChIP数据,其中145个基因是E2FA或 E2FB结合基因(图8A),这与最近的证据一致,即典型的E2FA/B可能通过与RBR1的关联在细胞周期基因的抑制中发挥关键作用。
E2F结合上调基因列表中富集的GO类别主要指DNA修复、重组修复以及对伽马辐射和X射线的反应。从下调基因和上调基因中选择一些基因进行定量 RT-PCR分析,证实了 RNA-Seq 的结果(图8B,C)。值得注意的是,在e2fa-2 e2fb-1双突变体中上调的PARP1和SMR7基因的表达在e2fa-2 e2fb-1 sog1三重突变体中受到抑制。与没有转录抑制的MCM9基因不同,前两个基因是真正的SOG1靶基因,表明E2FA和E2FB的缺失会引发SOG1依赖性转录反应(图8C)。因此,在e2fa-2 e2fb-1双突变体中上调的345个基因中,有43个是SOG1的靶基因,进一步证实了E2FA和E2FB的缺失会引发复制胁迫和SOG1依赖性的DDR基因激活。

图8. e2fa-2 e2fb-1突变体差异表达基因分析
04 研究小结
在本研究中,作者研究了E2FA和E2FB参与复制胁迫反应的情况。令人惊讶的是,作者发现E2FA和E2FB与SOG1有许多共同的靶标。此外,作者还发现,尽管存在复制胁迫,但细胞周期的进展需要E2FB而非E2FA的活性。对SOG1和E2F共同靶标表达行为的深入分析表明,E2FA和E2FB在这一通路中既互补又有区别。
在未来还需要进行更精细的研究,以了解在基因表达水平上发生的一系列事件,以及 E2FA、E2FB、SOG1和可能的其他E2F家族成员之间的相互作用是如何实现对细胞周期和DNA修复基因的精细调控,从而在不损害基因组完整性的情况下维持生长的。

图9. SOG1,E2FA和E2FB作用于不同的和共同的靶标,以微调植物的DDR
原文链接:https://doi.org/10.1101/2023.01.06.523015
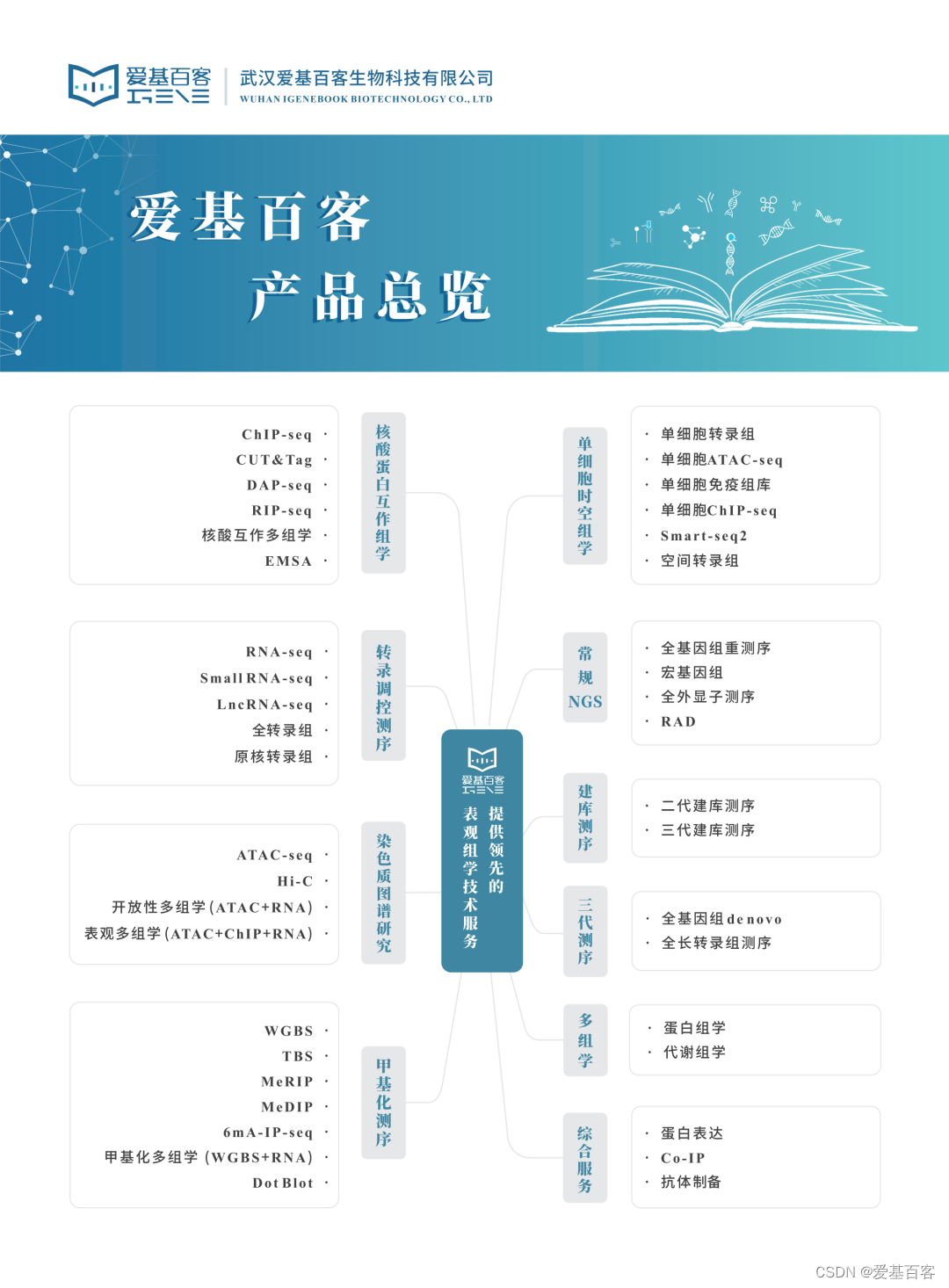
爱基百客ChIP-seq相关介绍
ChIP-seq技术将染色质免疫共沉淀和二代测序技术结合,是研究体内蛋白质与DNA相互作用的有力工具,可用于组蛋白修饰、RNA聚合酶、转录因子和辅因子以及G4链体(G4)等方面的研究,技术成熟稳定。爱基百客ChIP-seq可提供:
-
ChIP-seq 测序分析
Peak分析: Peak注释和分布分析,Peak关联基因的GO、KEGG的注释和富集分析, 转录因子和Motif分析等。
多样本差异分析:差异 Peak 分布情况统计,差异 Peak 关联基因GO、KEGG 功能注释与富集,转录因子预测,Motif 预测等。
- 后续验证
01 ChIP-qPCR
分析组蛋白修饰/转录因子与染色质区域的结合情况,揭示染色质状态和基因表达调控之间的关系,真实反映结合特性。
02 EMSA
基于DNA-蛋白质复合体在聚丙烯酰胺凝胶电泳(PAGE)中的迁移率不同,检测活化的与DNA结合的蛋白转录或调节因子。
03 双荧光素酶报告实验
检测转录因子与靶启动子的特异结合。
- 爱基百客ChIP-seq三大优势
优势一:项目经验丰富,研究物种200+种,累计实验2000余次。全面覆盖医口和农口等不同样本,不惧特殊样本(如脂肪组织、高淀粉组织和真菌类),抗体经验也极其丰富(多种组蛋白修饰、转录因子、标签抗体以及p300和RNApol II等均有涉及);
优势二:提供前期实验设计、测序、分析以及后期验证(ChIP-qPCR、EMSA)一站式服务;
优势三:项目文章多次发表于Cancer Cell、Nature Plants、Nature Metabolism以及Plant Cell等期刊。