乳腺癌是全球最常见的癌症,也是全球女性癌症相关死亡的主要原因。根据雌激素和孕激素受体以及人类表皮生长因子受体 2 (HER2) 的表达,乳腺癌可分为激素受体阳性、HER2 阳性或三阴性乳腺癌 (TNBC)。在主要亚型中,TNBC 的远处转移风险最高,预后最差。约 30% 的转移性 TNBC 患者出现脑转移,总生存期最短。KMT2C和KMT2D是编码组蛋白H3赖氨酸4(H3K4)甲基转移酶的基因,在TNBC中突变频率最高,但这些突变如何影响表观基因组和转录组以促进肿瘤发生尚不清楚。
2024年6月26日,来自美国丹娜-法伯癌症研究所的Kornelia Polyak团队在Nature Cell Biology上在线发表了文章Loss of Kmt2c or Kmt2d drives brain metastasis via KDM6A-dependent upregulation of MMP3,发现在非转移性TNBC小鼠模型中,Kmt2c或Kmt2d的缺失会导致转移(尤其是脑转移),揭示了KMT2C或KMT2D缺失通过KDM6A依赖的方式促进MMP3的表达,从而驱动TNBC的脑转移的新机制,不仅在表观遗传层面为TNBC的治疗提供了新的视角,也为开发针对脑转移的靶向治疗策略提供了潜在靶点。

「 研究路线 」
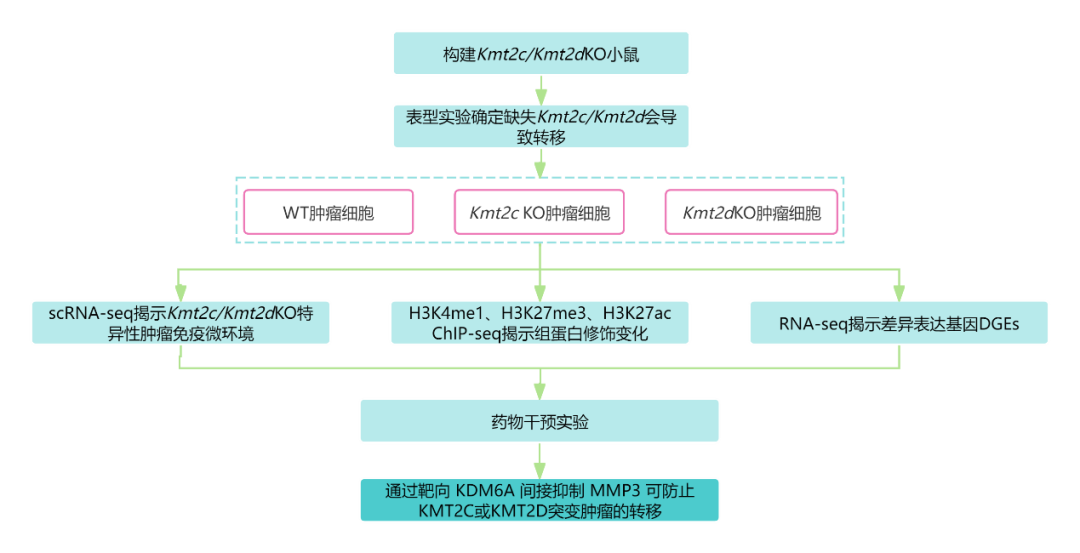
「 研究结果 」
01
缺乏Kmt2c/Kmt2d会导致转移
KMT2C和KMT2D是三阴性乳腺癌(TNBC)中频繁突变的基因,分别在8.0%和8.7%的肿瘤中检测到突变。这些突变大多数为截短或错义突变,暗示功能丧失。与匹配的原发性TNBC相比,KMT2C和KMT2D在远处转移中的表达显著降低(Fig.1a ),提示它们的功能丧失可能与转移有关。
为了探究Kmt2c/ Kmt2d基因缺失的后果,研究者们通过转染带有mCherry标签的sgRNA库和表达Cas9及绿色荧光蛋白(GFP)的质粒,在非转移性的168FARN和67NR小鼠乳腺肿瘤细胞系中敲除了这些基因(Fig.1b)。敲除效率通过测序得到验证,并通过免疫印迹分析确认了蛋白表达的减少(Fig.1c)。通过将168FARN细胞与H2B-mCherry共转染后注入免疫健全的BALB/c雌鼠的乳腺脂肪层(MFPs)中(Fig.1d),研究发现Kmt2c或Kmt2d的缺失并未显著影响原发肿瘤的生长(Fig.1e),但在敲除细胞而非野生型(WT)细胞注射的小鼠的肝脏、肺和大脑中检测到了mCherry+的微小转移灶(Fig.1f,g)。通过心脏内注射和流式细胞术进行的定量转移评估显示,敲除细胞在小鼠大脑中有显著富集,但在肝脏或肺组织中没有(Fig.1h,i)。此外,H&E染色和股骨切片分析证实了在Kmt2c和Kmt2d KO组中观察到的多器官转移表型(Fig.1j)。这些结果表明Kmt2c或Kmt2d的缺失赋予了肿瘤细胞多器官转移的能力。
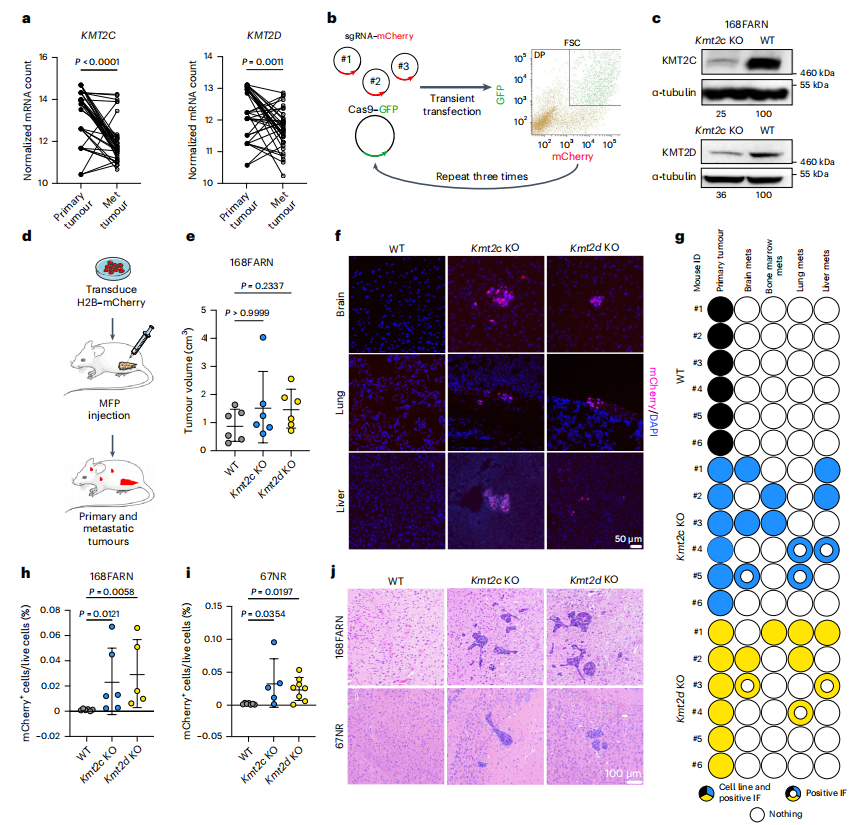
Fig1.Kmt2c或Kmt2d的缺失会诱导多器官转移
02
Kmt2c KO和Kmt2d KO特异性肿瘤免疫微环境
研究发现Kmt2c和Kmt2d 的缺失可能会影响肿瘤细胞对免疫检查点抑制剂的敏感性,并通过scRNA-seq分析了这些基因敲除(KO)肿瘤细胞与野生型(WT)肿瘤细胞在免疫微环境中的差异(Fig.2a)。Kmt2c KO和Kmt2d KO肿瘤细胞表现出与WT细胞不同的基因表达模式(Fig.2b,c),表现出几种免疫检查点基因上调(Fig.2d,e),尤其是程序性死亡配体1(PD-L1)(Fig.2f,g)。免疫微环境中,Kmt2c KO和Kmt2d KO肿瘤中,免疫抑制性T调节细胞的标记较高,而CD8+ T细胞在Kmt2c KO中比例上升且显示出较高的耗竭趋势(Fig.2h-n)。免疫荧光证实,在Kmt2c KO肿瘤中,特别是CD8+ T细胞的数量显著多于WT(Fig.2o,p)。此外,KO肿瘤中某些吸引免疫细胞的因子也上调。在免疫缺陷小鼠模型中,Kmt2c或Kmt2d 的缺失并未直接导致主要的免疫抑制(Fig.2q),表明它们的缺失可能不是转移的主要驱动因素。
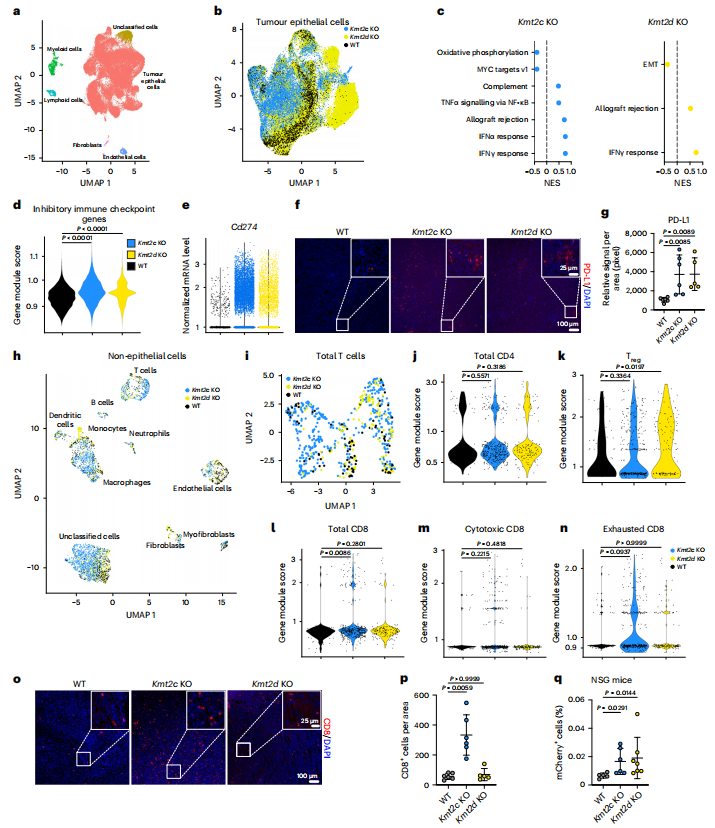
Fig 2.Kmt2c和Kmt2d缺失对肿瘤免疫微环境的不同影响
03
Kmt2c KO和Kmt2d KO会改变染色质状态和转录本表达
为了解析KMT2C或KMT2D基因丢失诱导的细胞内在变化,研究者深入探究了KMT2C和KMT2D两种组蛋白甲基转移酶基因敲除(KO)对细胞组蛋白修饰的影响。定量组蛋白质谱分析显示,与野生型(WT)细胞相比,两种KO细胞的组蛋白修饰模式相似(Fig.3a),但H3K4me1和H3K27me3在Kmt2c KO细胞中显著减少,但在Kmt2d KO细胞中没有减少,而H3K27ac则在2种KO细胞系中都显著增加(Fig.3b)。免疫印迹分析显示H3K4me1水平相似,但在两种KO细胞系中H3K27me3减少,H3K27ac增加(Fig.3c)。此外,通过ChIP-seq技术,研究者观察到Kmt2c KO和Kmt2d KO细胞中H3K4me1和H3K27ac的峰值出现显著的增加或减少,而H3K27me3的峰值变化不大。这些变化是局部的而非全局性的,并且每种KO细胞的变化具有独特性(Fig.3e,f,g)。由于KMT2C和KMT2D是H3K4的甲基转移酶,但H3K27ac的增加可能是由于这些酶活性丧失的间接效应。P300,一种H3K27乙酰转移酶,其信号强度与H3K27ac的变化显著相关,表明P300可能在KO细胞中调节H3K27ac的水平(Fig.3i)。同时,KDM6A,一种H3K27me3的去甲基化酶,其ChIP-seq结果显示KO细胞中KDM6A峰值显著增加,但与H3K27ac的增加重叠较少 (Fig.3j),两种KO细胞系之间增加的独特的KDM6A峰值多于共有的(Fig.3k),这可能影响H3K27me3的水平。
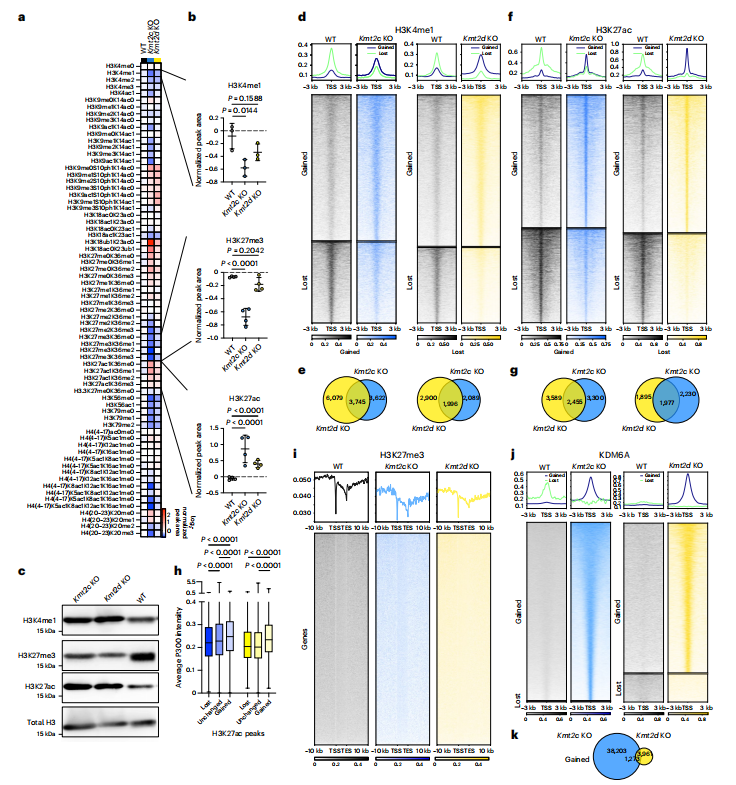
Fig 3.Kmt2c KO和Kmt2d KO细胞中组蛋白和KDM6A占用的改变
然后,研究者对Kmt2c KO和Kmt2d KO细胞进行了RNA-seq分析,并与野生型(WT)相比识别了差异表达基因(DGEs)(Fig.4a)。在两种KO细胞系之间的DGEs独特性多于共享性(Fig.4b),但都影响了上皮-间充质转换(EMT)的平衡。值得一提的是,即使在没有EMT的情况下,也能观察到Kmt2c和Kmt2d缺失促进转移的作用。为了评估染色质变化对转录组的影响,研究者使用结合与表达靶标分析(BETA)整合了RNA-seq和ChIP-seq数据。增加的H3K4me1、H3K27ac和KDM6A峰值与Kmt2c KO和Kmt2d KO细胞中上调的基因显著相关,而丢失的H3K4me1和H3K27ac峰值与下调的基因显著相关(Fig.4c)。最后,研究者重叠了在Kmt2c KO或Kmt2d KO细胞中BETAs上调相关性基因。最大的基因集在所有三种BETAs中共享,表明H3K4me1、H3K27ac和KDM6A对目标基因的调控相似(图4d)。这些结果提示KMT2C/D的缺失可通过影响染色质状态来调控基因表达,进而可能影响肿瘤的转移,而KDM6A可能是KMT2C/D缺失相关转录组变化的介质。
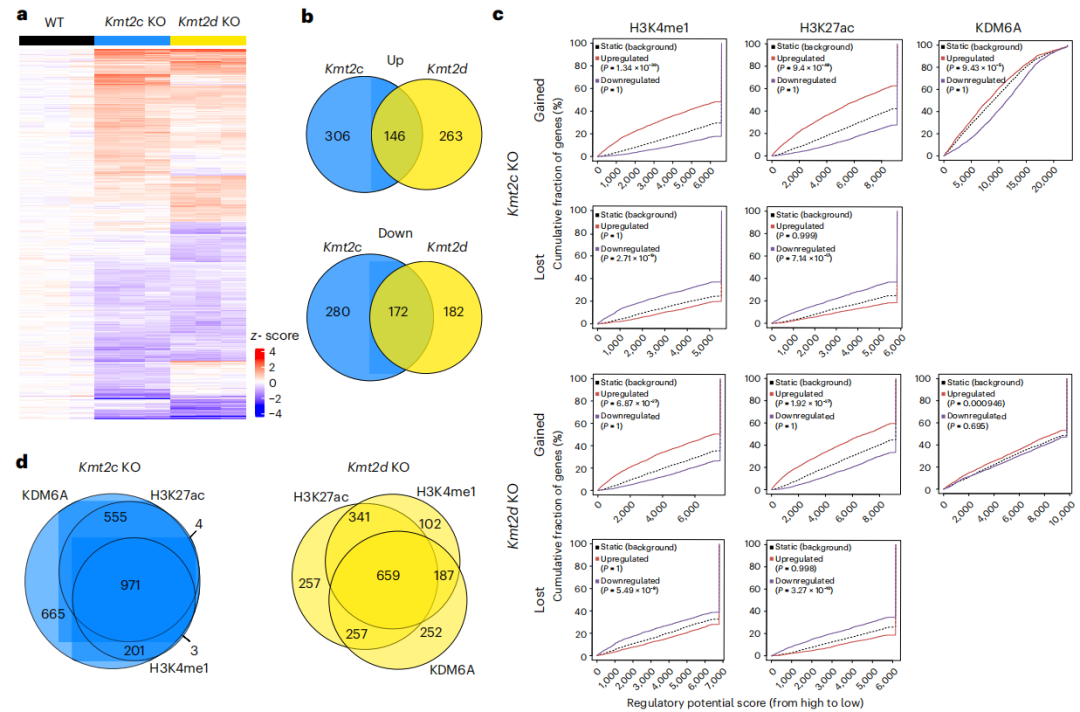
Fig4.KDM6A和组蛋白重塑与Kmt2c KO和Kmt2d KO的转录组学变化相关
04
阻断KDM6A通过降低Mmp3来减少脑转移
为了识别Kmt2c KO和Kmt2d KO细胞转移表型的共同表观遗传调控因子,研究者整合了显著增加的H3K4me1和H3K27ac peaks以及在癌细胞的RNA-seq和scRNA-seq中显著上调的基因,鉴定出基质金属蛋白酶3 (Mmp3)是唯一重叠的基因(Fig.5a)。研究者确认了Mmp3位点上富集的H3K4me1和H3K27ac信号强度(Fig.5b),并发现两种168FARN和67NR KO衍生细胞中显著上调了Mmp3表达(Fig.5c,d)。更重要的是,在具有KMT2C突变的人类三阴性乳腺癌(TNBC)中,MMP3表达显著高于WT肿瘤,并且MMP3高表达的肿瘤具有显著更高的KMT2C突变频率(Fig.5e)。
为了在功能上表征Mmp3,研究者在168FARN Kmt2c KO、Kmt2d KO、WT细胞中使用shRNA下调其表达。将细胞注入小鼠心内,用流式细胞术定量转移细胞,结果显示Mmp3下调可显著降低Kmt2c KO和Kmt2d KO细胞的脑转移(图5f,g)。先前的临床试验表明,MMP抑制剂毒性高,疗效低。然而,本文的数据表明,KDM6A可能是Kmt2c和Kmt2d损失相关转录组变化的中介(Fig.3c,d);因此,抑制KDM6A可能是一种间接靶向MMP3的途径。
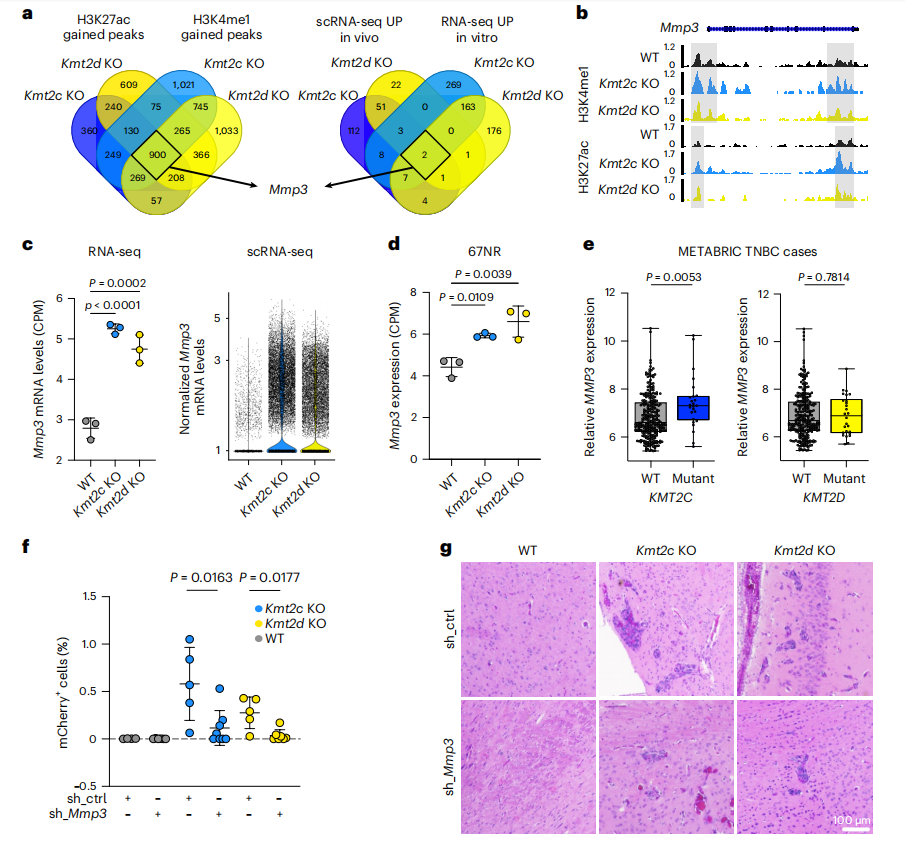
Fig5.Mmp3驱动Kmt2c KO和Kmt2d KO细胞脑转移
研究者构建了168FARN Kmt2c和Kmt2d表达kdm6a靶向shRNAs的KO和WT细胞,结果显示Kdm6a下调导致Mmp3表达显著降低(Fig.6a), Kmt2c KO和Kmt2d KO细胞脑转移显著减少(Fig.6b,c)。使用KDM6A、KDM1A和P300的抑制剂处理细胞,发现KDM6A抑制剂GSK-J4能够降低H3K27ac的水平,进而显著减少两种KO细胞系中Mmp3的表达(Fig.6d)。此外,P300的抑制也特异性地在KO细胞中减少了Mmp3的表达(Fig.6e)。通过ChIP-seq数据分析,研究者发现Kmt2c KO和Kmt2d KO细胞中Mmp3启动子区域的H3K27me3水平降低,P300水平升高,而KDM6A的水平并没有一致变化,表明KDM6A可能不是通过直接结合启动子来调控Mmp3的表达。研究者还观察到MMP基因簇中的多个成员在KO细胞中表达上调,并通过抑制KDM6A或P300来降低这些基因的表达,这支持了KDM6A在远程调控元件中发挥作用。最后,研究者评估了KDM6A抑制剂GSK-J4在预防脑转移方面的治疗潜力。通过在小鼠模型中预处理细胞和体内给药,发现GSK-J4治疗显著减少了Kmt2c KO和Kmt2d KO细胞在小鼠大脑中的转移,而对骨转移的影响不大(Fig.6f)。这些结果表明通过靶向 KDM6A 间接抑制 MMP3 可防止KMT2C或KMT2D突变肿瘤的转移。
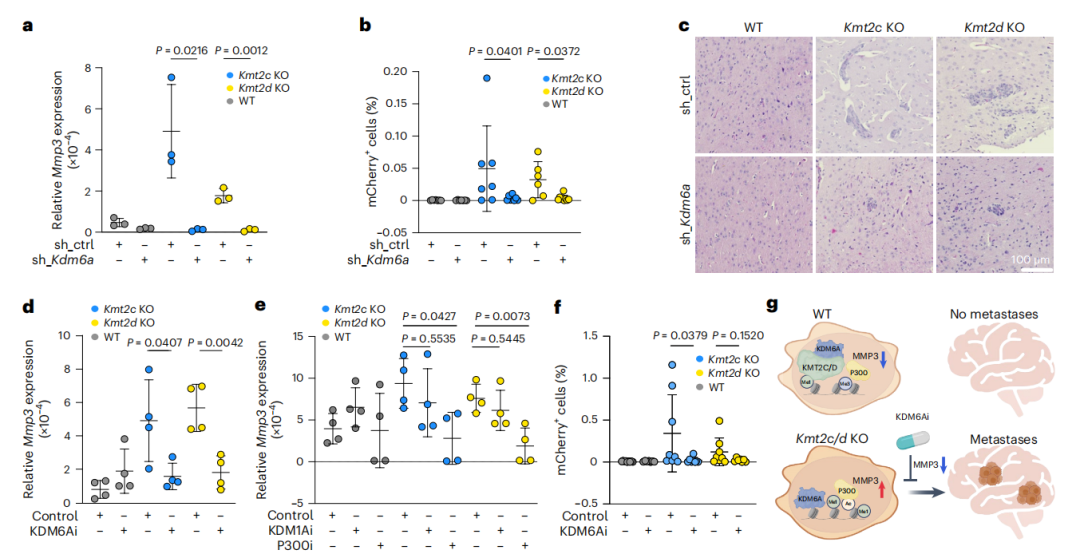
Fig6.抑制KDM6A可降低Kmt2c KO和Kmt2d KO诱导的Mmp3表达和脑转移
综上所述,本研究阐明了KMT2C/D突变导致的染色质重塑和组蛋白修饰变化,通过KDM6A间接影响MMP3的表达,从而诱导TNBC远端转移的分子机制。同时证明通过抑制KDM6A的活性,可以减少MMP3的表达,并可预防由KMT2C/D突变引起的脑转移(Fig.6g),不仅增进了人们对TNBC转移机制的理解,也为开发新的治疗策略提供了有价值的信息。