点击蓝字
关注我们
编译:张璐 校稿:张慧林
论文ID
原名:Mobile resistome of human gut and pathogen drives anthropogenic bloom of antibiotic resistance
译名:人类肠道和病原菌的可移动抗性组驱动环境中抗生素抗性增长
第一作者:Kihyun Lee & Dae-Wi Kim
通讯作者:Chang-Jun Cha
通讯作者单位:
Department of Systems Biotechnology and Center for Antibiotic Resistome, Chung-Ang University, Republic of Korea
期刊:Microbiome
发表时间:2020

研究背景
近几十年来,难以用常规抗生素治疗的细菌感染种类愈加增多。病原菌的抗生素抗性可通过基因突变或由可移动遗传元件(mobile genetic elements, MGEs)介导的水平基因转移(Horizontal gene transfer, HGT)等方式获得。由于HGT可以在不同克隆、物种或者生境之间发生,借此获得抗生素抗性基因(antibiotic resistance genes, ARGs)的进化路径相比基于突变的机制要复杂得多。已有大量研究聚焦环境与临床细菌ARGs的关联,并发现多种全球广泛分布的ARGs可溯源至环境或动物微生物组,如qnrA、blaCTX-M和mcr-1等。因此,需要对人、动物和环境进行整合分析,以深入探究ARGs的分布和传播。目前,我们对人类活动如何影响环境抗性组(resistome)仍缺乏了解;而要回答这一问题,需要对受不同程度人为影响地点的比较研究。汉江是朝鲜半岛的一条主要河流,起源于东部原始山区,流经首尔,最后注入黄海;流经区域人口密度差异巨大,适用于系统评估人类活动对环境抗性组的影响。
研究方法
(1)样品采集
作者分别在2016年5月、8月和2017年2月,在汉江沿线15个位点采集表层至1米深水样。
(2)16S扩增子测序分析
水样过滤膜提取DNA,对16S rRNA基因V3-V4区扩增测序,以97%序列相似度划分OTU, 使用RDP classifier注释,计算Chao 1和系统发育多样性指数。
(3)ARG和MGE数据库
下载CARD(Comprehensive Antibiotic Resistance Database)数据库并修改后用于宏基因组分析,从NCBI蛋白质数据库下载整合子整合酶(integron integrase, IntI)和转座酶(transposase)序列,聚类、分类后作为数据库用于宏基因组分析。
(4)宏基因组测序分析
宏基因组测序数据经质控、组装为重叠群(contig)后,对重叠群注释物种,预测蛋白质编码序列并用COG数据库和本研究修改建立的CARD、MGE数据库进行功能注释;通过与从NCBI下载的质粒序列比对获得类质粒(plasmid-like)重叠群;未经组装的宏基因组短序列经CARD数据库比对获得ARGs分布信息,序列丰度计算经由40个单拷贝基因数量标准化。
(5)高通量定量PCR(HT-qPCR)
使用SmartChip 实时PCR系统完成HT-qPCR,分别采用了343组ARG和36组MGE引物。
(6)公共数据库宏基因组和基因组数据分析
从已发表研究中获取来自6个国家健康成年人肠道宏基因组数据;从PATRIC数据库下载人类病原菌基因组,筛选后共获得24428个基因组;基于UniProt Proteomes下载97325个细菌基因组,注释ARGs、COGs(Clusters of orthologous groups of proteins,直系同源蛋白簇)和MGEs;获取地球微生物组项目(The Earth Microbiome Project)12536个样品的OTU表,定义人类肠道样品中丰度最高的27个OTUs为人类粪便代表性OTUs。
(7)分离耐药菌和表型分析
使用添加抗生素的Mueller Hinton琼脂分离水样中的耐药菌(Antibiotic-resistant bacteria, ARB),基于16S rRNA基因序列比对EzBioCloud数据库鉴定菌种,用纸片扩散法测试分离菌种对18种抗生素的药敏性。
结果与讨论
(1)汉江下游ARGs急剧增多
汉江下游人口密度高(图1A),ARG总量比上游高2-16倍(HT-qPCR分析)或4.8-10.9倍(宏基因组分析,图1B)。下游ARG多样性也更高(图1C),主要富集了氨基糖苷类(aminoglycoside)、磺胺类(sulfonamide)、β-内酰胺类(β-lactam)、大环内酯-林可酰胺-链霉素 B(macrolide-lincosamide-streptogramin)、四环素类(tetracycline)和酰胺醇类(amphenicol)抗生素抗性基因(图1D)。ARG总丰度与地理距离、总氮和人口密度、纳税额、抗生素用药量等社会经济因素强相关,并与MGE丰度,尤其是整合酶丰度显著相关,但与细菌多样性、温度、溶解氧和pH的相关性较弱。

图1. 基于宏基因组测序和高通量定量PCR的汉江抗生素抗性组分布分析
(2)汉江上下游ARGs组成、细菌群落、功能基因及粪便污染差异
作为粪便污染和人类活动影响的指示物,代表性粪便OTUs和crAssphage在下游的丰度均显著高于上游,并与ARG丰度显著相关,表明粪便污染对下游抗性组的影响。然而,这些粪便指示物的相对丰度远低于ARGs(图2A),说明ARG在下游增多不仅由粪便细菌的输入所致。上下游ARGs组成差异显著,但细菌群落和功能组成差异较小,而细菌群落组成主要受季节影响(图2C),这说明汉江下游人类活动对抗性组比对细菌群落的影响更强。

图2. 对比上下游的粪便污染指示物、ARGs、OTU和功能基因
(3)河流抗性组的空间演变
本文关注了在河水流动过程中哪些ARGs被保留,哪些ARGs输入或流失。结果显示,ARG种类的新增或流失对ARG总丰度的影响远小于物种输入或消失带来的细菌群落动态变化,揭示了汉江微生物组和抗性组的空间演变差异。作者将存在于≥90%样品的ARGs定义为核心(core)ARGs,发现下游核心ARGs种类远多于河流(包括上下游)核心ARGs。下游核心抗性组包括氨基糖苷类、β-内酰胺类、四环素类、酰胺醇类和大环内酯-林可酰胺-链霉素B类抗生素广谱抗性基因。
(4)ARGs和MGEs的关联与水平基因转移(HGT)
下游intI1和类质粒重叠群丰度剧增。ARGs普遍与MGEs共现于相同重叠群,尤其β-内酰胺酶基因的GES和OXA型、磺胺类抗性基因(sul)、四环素抗性基因(tet)、大环内酯磷酸转移酶基因(mphD)、氯霉素乙酰转移酶基因(catB)和多种氨基糖苷失活基因等,与MGEs共现率高于75%。基于对河流ARGs的HGT网络分析,作者发现Enterobacteriaceae、Moraxellaceae和Pseudomonadaceae是经水平基因转移的ARGs的主要宿主,而sul1基因的宿主范围最广。
(5)比较河流抗性组和人类肠道、病原菌抗性组
作者对480条汉江ARG序列和从公共数据库中获得的人类肠道宏基因组和病原菌基因组中ARG序列(分别为1805和361291条)聚类获得9567个ARG序列簇,其中161个包括河流ARGs。肠道和病原菌ARGs更多见于下游(图3A)。河流宏基因组和肠道宏基因组或病原菌基因组之间少有共同的单拷贝基因(SCGs,是系统发育分类的标记基因),却有大量共同的ARGs,尤其是下游区域(图3B-E)。这表明,河流和人类肠道、病原菌中有诸多相同的ARGs,而不是ARBs。这些共有的ARGs在下游的相对丰度是上游的16.8倍,而且在下游中人源ARGs是河流特有ARGs丰度的4倍,再次表明人源污染是下游ARGs的主要来源。同时,河流特有ARGs在下游的丰度也有明显升高,再次印证污染不是下游ARGs增多的唯一原因。通过在公共数据库中的细菌基因组中搜索人类相关ARGs(human-related ARGs,包括肠道、病原菌ARGs)和河流特有ARGs发现,前者与MGE的关联频次更高(图3G)且宿主范围更广(图3H),表明人类相关ARGs在物种间的可移动性和水平基因转移是下游ARGs增多的重要原因。
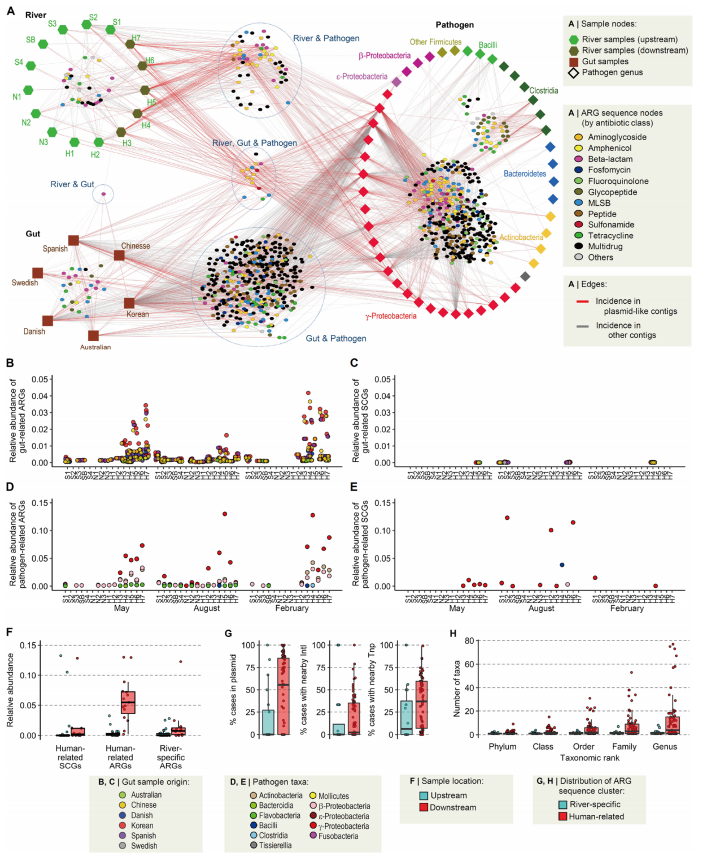
图3. 河流抗性组和人类肠道、病原菌抗性组的关联
(6)ARG宿主的系统发育多样性
根据对重叠群的物种注释,ARGs的主要宿主为Proteobacteria门的Aeromonadacea、Enterobacteriaceae、Moraxellaceae、Pseudomonadaceae和属于Actinobacteria门的Microbacteriaceae、Mycobacteriaceae。下游ARGs猛增主要由以Proteobacteria门细菌为主的少部分细菌携带的人源ARGs所驱动。
(7)汉江ARB的表型特征。
作者从汉江河水中分离出1557个ARB菌株,物种组成与宏基因组分析推测的ARGs主要宿主一致。ARB的抗性表型主要与系统发育分类有关。相较于上游,从下游分离得到的大部分菌株对抗生素的敏感性下降。本文同时采用基于培养和不依赖培养的方法全面揭示了ARG宿主范围和表型水平的抗性组。未来将关注个体基因组和泛基因组(pan-genome)层面特定可移动ARGs传播的进化机制和环境抗性组如何影响临床抗性组。
结论与意义
本文以一条沿线受不同程度人为扰动影响的河流为模式系统,深入揭示了人类活动如何影响环境抗生素抗性组:粪便污染致使人源抗性基因输入河流抗性组;然而,是人源的可移动抗性基因,而不是耐药菌,在环境中传播最终导致抗性基因的急剧增长。
猜你喜欢
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature Cell专刊 肠道指挥大脑
系列教程:微生物组入门 Biostar 微生物组 宏基因组
专业技能:学术图表 高分文章 生信宝典 不可或缺的人
一文读懂:宏基因组 寄生虫益处 进化树
必备技能:提问 搜索 Endnote
文献阅读 热心肠 SemanticScholar Geenmedical
扩增子分析:图表解读 分析流程 统计绘图
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
在线工具:16S预测培养基 生信绘图
科研经验:云笔记 云协作 公众号
编程模板: Shell R Perl
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流、快速解决科研困难,我们建立了“宏基因组”专业讨论群,目前己有国内外5000+ 一线科研人员加入。参与讨论,获得专业解答,欢迎分享此文至朋友圈,并扫码加主编好友带你入群,务必备注“姓名-单位-研究方向-职称/年级”。PI请明示身份,另有海内外微生物相关PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。

学习16S扩增子、宏基因组科研思路和分析实战,关注“宏基因组”
点击阅读原文