今天给同学们分享一篇生信文章“PCTAIRE Protein Kinase 1 (PCTK1) Suppresses Proliferation, Stemness,and Chemoresistance in Colorectal Cancer through the BMPR1B-Smad1/5/8 Signaling Pathway”,这篇文章发表在Int J Mol Sci期刊上,影响因子为5.6。

结果解读:
高PCTK1表达与更有利的CRC预后相关
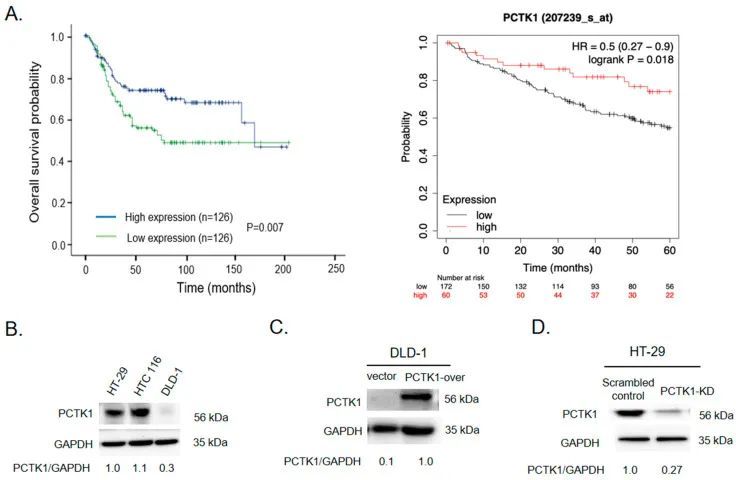
首先,为了探索PCTK1在CRC中的作用,作者使用公共数据库分析了PCTK1表达与CRC临床结果之间的相关性。如图1A(左侧面板)所示,CRC标本中PCTK1的较低表达与GSE41258数据集中的不良预后显著相关(n = 252,p = 0.007)。同样,在图1A(右侧面板)中,对另一个CRC数据集(GSE17538,n = 232,p = 0.018,HR = 0.5(0.27–0.9))的分析也表明,较低的PCTK1导致不良的总生存率。那些PCTK1表达较高的患者具有更有利的生存结果,表明PCTK1作为CRC进展的抑制剂。为了进一步研究PCTK1在调控CRC进展中的机制,作者尝试操纵PCTK1基因,并在CRC细胞中生成稳定过表达PCTK1或沉默PCTK1的细胞系。通过Western blotting确定了不同人类结肠腺癌细胞系(HT-29、DLD-1和HCT116)中的PCTK1表达。如图1B所示,所有的CRC细胞系中都表达PCTK1,但在DLD-1细胞中表达量非常低。因此,根据对不同结直肠癌细胞系中PCTK1表达水平的评估,作者选择了用于接下来的实验的细胞系。接下来,在HT-29细胞中建立了稳定的PCTK1基因敲低细胞系(PCTK-KD)和对照细胞系(乱序对照)。在DLD-1细胞中也生成了对照细胞系(载体)和稳定过表达PCTK1的细胞系(PCTK1-over)。使用Western blotting确认了稳定过表达和敲低PCTK1的细胞系中PCTK1的表达(图1C、D)。此外,使用CRISPR/Cas9技术通过去除外显子2至6来创建了两个结直肠癌细胞系DLD-1和HCT116的PCTK1基因敲除细胞系。
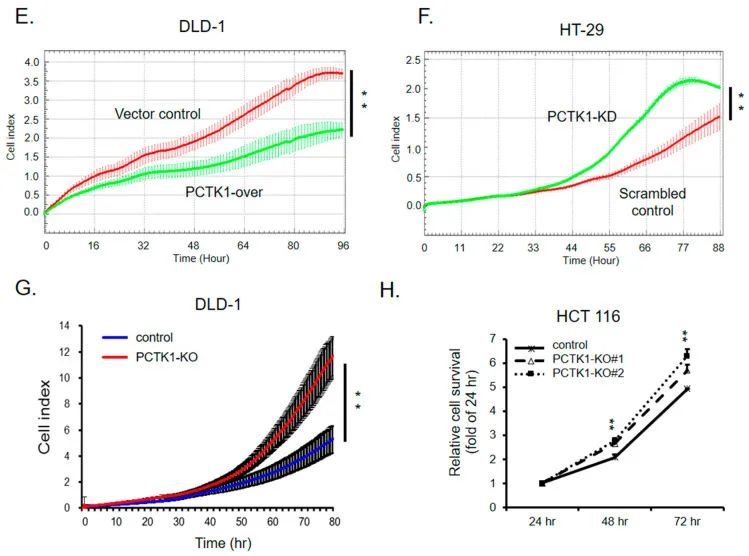
PCTK1表达抑制结直肠癌细胞增殖
接下来,作者检查了PCTK1表达的失调是否影响了CRC细胞的增殖。从RTCA结果构建的细胞指数曲线显示,PCTK1过表达、PCTK1-KD和PCTK1-KO细胞与其对照组之间存在显著差异。在DLD-1细胞中过表达PCTK1导致细胞增殖减少。然而,PCTK1-KD或PCTK1-KO细胞相对于对照组细胞呈现更高的增殖率(图1E-H)。这些功能增强和功能丧失实验的结果表明,PCTK1抑制了CRC细胞的增殖。
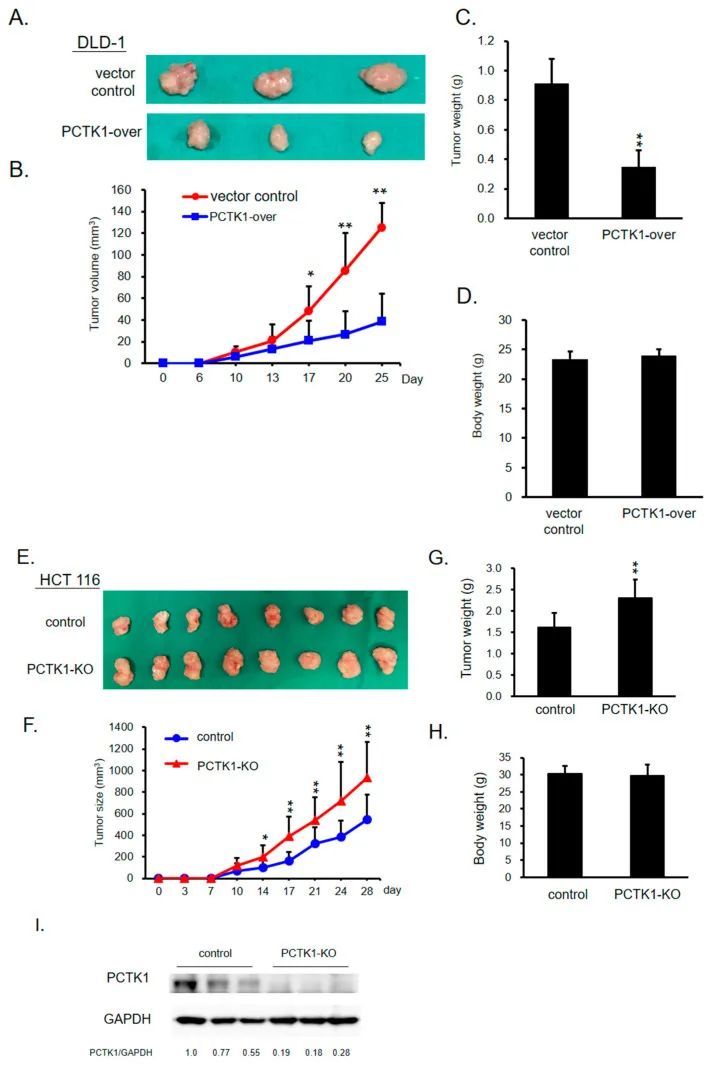
PCTK1在体内抑制了肿瘤发生和肿瘤生长。
PCTK1过表达与对照DLD-1细胞以及PCTK1-KO与对照HCT116细胞被皮下植入裸鼠体内,监测其对肿瘤的发生和进展的影响。与对照组相比,PCTK1过表达细胞植入的裸鼠体内的异种移植瘤生长、体积和重量(图2A-C)明显较低。而PCTK1-KO组的异种移植瘤生长、体积和重量(图2E-G)则持续显著高于对照组。通过Western blotting检测,确定了小鼠肿瘤组织中PCTK1的表达情况(图2I)。综上所述,这些结果表明PCTK1在结直肠癌的体内肿瘤抑制中起到了作用。
PCTK1在结直肠癌中负调化疗抗性
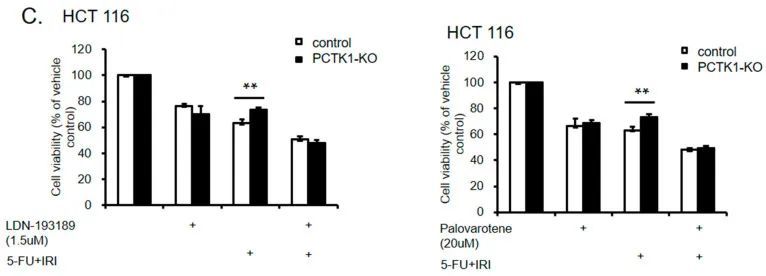
化疗是CRC治疗的主流方法[19]。然而,化疗耐药是癌症治疗中的主要障碍,导致癌症复发[20]。作者发现CRC患者的PCTK1水平较低与整体生存率较差相关(图1A)。因此,作者很好奇PCTK1是否在CRC的化疗反应中起到了调节作用。作者对HCT 116的对照组和PCTK1-KO细胞进行了5-氟尿嘧啶(5-FU)和伊立替康(IRI)的不同剂量处理,这是CRC标准一线化疗药物之一。数据显示,细胞存活率呈剂量依赖性下降。然而,在最高剂量的5-FU下,组间细胞存活率的显著差异仅在5-FU组中观察到(图3A)。一些临床研究已经报道,IRI显著降低了5-FU基础治疗对CRC的治疗耐药性[21, 22, 23]。与单一药物相比,已被证明能够取得更好治疗效果的联合化疗方案通常更受欢迎用于mCRC治疗。在不同剂量的IRI处理下,HCT 116 PCTK1-KO细胞的存活率明显高于对照组细胞(图3B)。此外,HCT 116 PCTK1-KO细胞在仅接受IRI治疗和与低剂量5-FU联合治疗时,相对于对照组细胞,细胞存活率增加(图3C)。同样,在仅接受IRI治疗和与5-FU联合治疗时,HCT 116 PCTK1敲除细胞的克隆形成能力也高于对照组细胞(图3D)。为了进一步确定PCTK1对结直肠癌化疗敏感性的影响,使用annexin V/propidium iodide双染法评估了HCT 116对照组与HCT 116 PCTK1-KO细胞在不同化疗方案下的细胞凋亡率。在仅接受IRI单独治疗(32.68% ± 3.17%对23.32% ± 3.98%)和IRI-5-FU联合治疗方案(37.77% ± 3.53%对27.56% ± 1.99%)下,HCT 116 PCTK1-KO细胞的凋亡率较低(图3E、F)。通过Western blotting评估了HCT 116对照组与PCTK1-KO细胞在化疗药物治疗后的凋亡相关蛋白的表达情况。在IRI治疗和IRI-5-FU治疗后,相对于对照组细胞,PCTK1-KO细胞中抗凋亡蛋白Bcl-2相对Bcl-xL的表达减少,而凋亡蛋白Bax、c-PARP、c-caspase3和p53的表达增加较少(图3G、H)。这些数据表明,PCTK1的敲除通过调节caspase依赖性凋亡抑制了化疗反应。这些结果还表明,PCTK1是结直肠癌治疗中IRI治疗(单独或与5-FU联合)敏感性的预测生物标志物。此外,作者还利用ROC Plotter平台根据PCTK1的表达水平评估结直肠癌患者对化疗治疗的反应。与作者的发现一致,对化疗反应差的患者(p = 0.0068)PCTK1的表达较低。


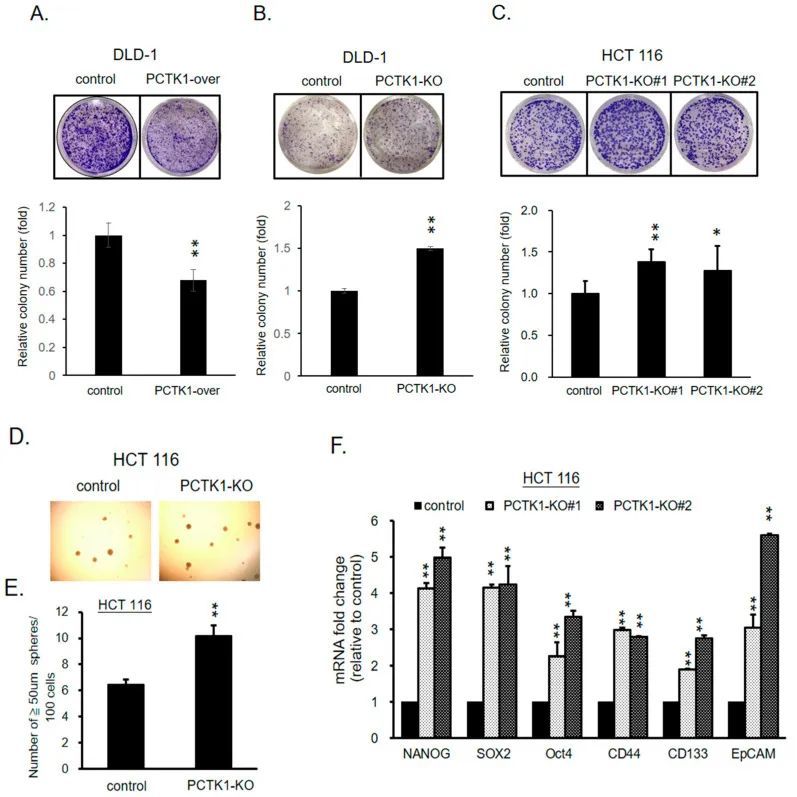
PCTK1表达改变了结直肠癌细胞的癌症干细胞特性
癌干细胞(CSCs)是肿瘤细胞的一个亚群,能够推动肿瘤的起始并负责维持肿瘤的异质性、增强增殖能力和治疗抵抗性[24]。作者的数据表明,PCTK1抑制了CRC的肿瘤生长和化疗反应。为了评估PCTK1对CRC细胞的CSC特性的影响,进行了克隆形成实验。PCTK1过表达显著阻断了DLD-1细胞的克隆形成,而PCTK1-KO的DLD-1和HCT116相对于对照组具有更强的克隆形成能力(图4A-C)。一项研究报告指出,球体形成是细胞自我更新能力的指标,这是CSCs的定义特征[25]。通过球体形成实验检测了PCTK1对CRC细胞的球体形成能力的影响,其中对照组和PCTK1-KO的HCT116细胞在含有B27、bFGF和EGF的无血清培养基中培养。在干细胞生长条件下,PCTK1-KO细胞形成的球体比对照组细胞更多(图4D,E)。一篇综述文章指出,已有研究涉及到多个表面标记物和多能性转录因子来鉴定CRC中的CSCs[26]。在此,PCTK1-KO细胞的CSC标记物(NANOG、SOX2、Oct4、CD44、CD133和EpCAM)的表达持续上调(图4F)。相反,PCKT1的过表达导致所有这些CSC标记物的显著下调。
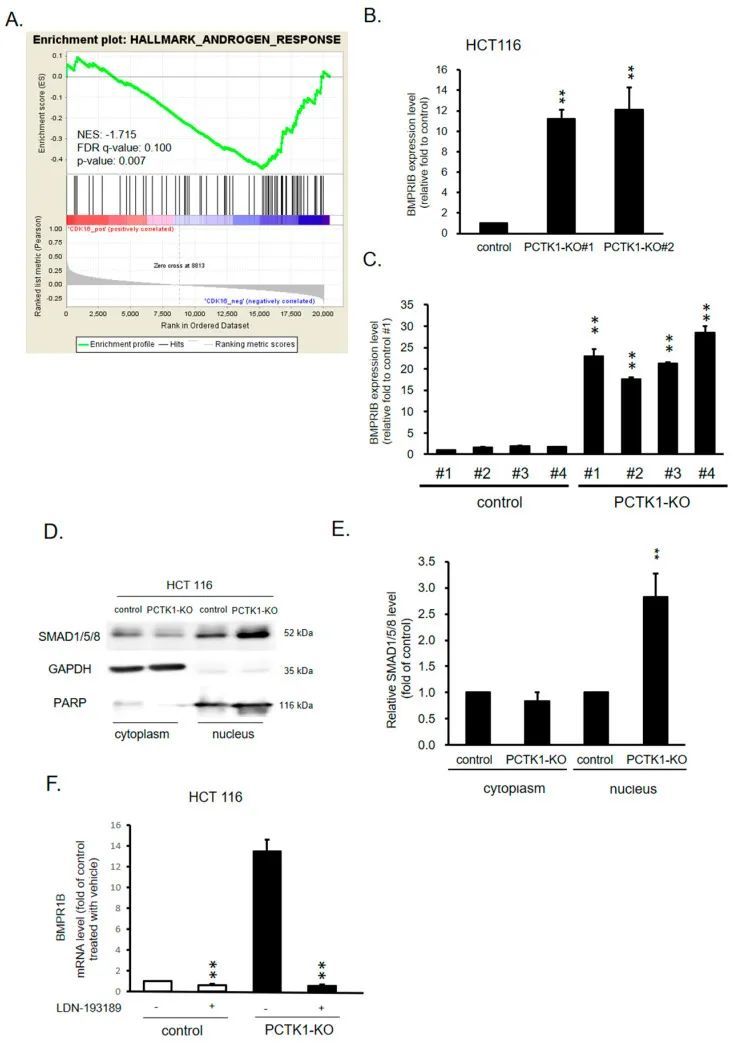
PCTK1通过BMPR1B-Smad信号抑制细胞增殖、CSC特性和化疗反应
为了研究PCTK1在细胞增殖和结直肠癌治疗反应中的直接基因靶点和信号通路,对PCTK1过表达和对照的结直肠癌细胞的RNA测序数据进行了GSEA分析。PCTK1过表达与雄激素反应信号通路呈负相关,根据GSEA分析,在雄激素反应基因集中观察到BMPR1B表达的显著降低(图5A)。为了验证这些结果,进行了RT-PCR实验。在HCT 116 PCTK1-KO细胞和异种移植瘤组织中,BMPR1B表达上调(图5B、C)。先前的研究表明,BMPR1B参与TGFβ/Smad信号通路,并与结直肠癌风险相关[27]。BMPR1B激活的受体激活SMAD蛋白(R-SMADs),Smad1/5/8,然后与Smad4形成复合物,并触发其核转位。另一方面,Smad4还可以通过正反馈机制调节经典的BMP/Smad信号通路[28, 29]。因此,作者使用Western blotting评估了HCT 116 PCTK1-KO细胞中Smad1/5/8的核转位。在HCT 116 PCTK1-KO细胞中,Smad1/5/8在细胞核中的表达上调(图5D,E)。GAPDH和PARP分别用作细胞质和细胞核的内部对照。已报道磷酸化的Smad1/5/8-Smad4复合物传递信号到细胞核,然后激活BMPR1B转录[28, 29]。为了进一步阐明Smad1/5/8在PCTK1-BMPR1B轴信号通路中的作用,检测了HCT 116对照组和PCTK1-KO细胞中经Smad1/5/8抑制剂LDN193189和palovarotene处理后的BMPR1B表达。在所有细胞中,LDN193189和palovarotene抑制了BMPR1B的表达,这证实了Smad1/5/8在经典BMP/Smad信号通路中的正反馈机制(图5F)。综上所述,这些结果表明PCTK1通过Smad1/5/8的正反馈机制调节BMPR1B。
BMPR1B敲低部分抑制了PCTK1敲除对结直肠癌细胞恶性表型和化疗抗性的促进
为了确定PCTK1介导的细胞增殖、CSC特性和化疗反应是否由BMPR1B介导,作者使用shRNA转染技术在PCTK1-KO细胞中敲除了BMPR1B。数据显示,BMPR1B的敲除部分逆转了HCT 116 PCTK1-KO细胞的增殖活性和集落形成能力(图6B、C)。此外,与HCT 116 PCTK1-KO/对照-shRNA细胞相比,HCT 116 PCTK1-KO/BMPR1B-shRNA细胞对IRI和IRI-5-FU治疗的细胞存活率降低。然而,HCT 116 PCTK1-KO/BMPR1B-shRNA细胞的细胞存活率高于对照组(图6D)。数据表明,PCTK1通过抑制BMPR1B来抑制细胞增殖、CSC特性和化疗耐药性。为了验证BMPR1B在CRC中的作用,作者进一步从Human Protein Atlas和GEPIA数据集中研究了BMPR1B在CRC的临床结果。数据显示,高表达的BMPR1B与CRC的总体生存率和无病生存率不良相关(图6E、F)。此外,使用Timer 2.0数据集在CRC患者中发现PCTK1与BMPR1B呈负相关(rho = -)。24,p = 1.99 × 10 −7 ) 和 cBioPortal(Spearman相关系数−0.32,p = 2.97 × 10 −10 )(图6G,H)。
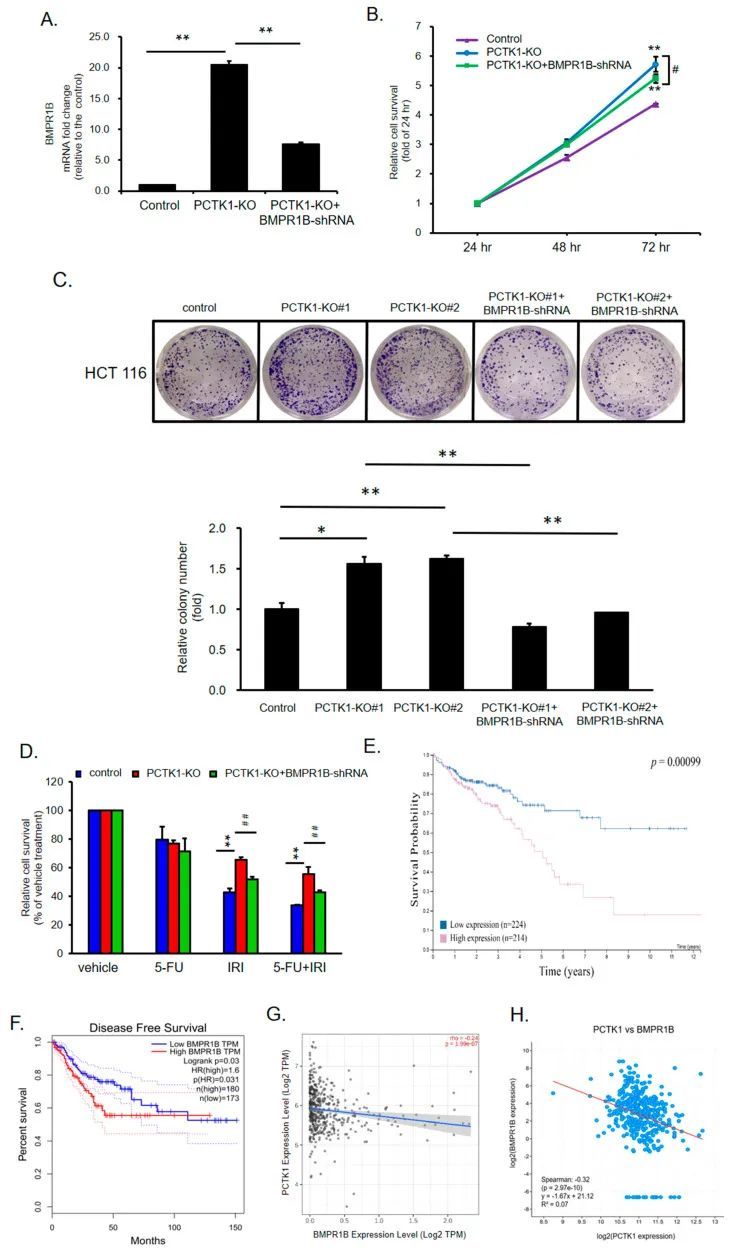
通过小分子药物对BMPR1B-SMAD1/5/8信号通路进行药理靶向,抑制了PCTK1基因敲除对结直肠癌细胞恶性表型和化疗抗性的促进作用。
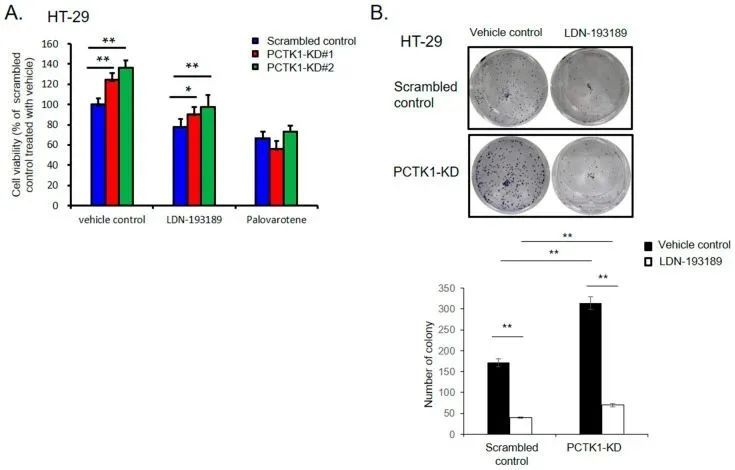
为了进一步评估PCTK1在结直肠癌细胞表型和化疗反应中通过BMPR1B-SMAD1/5/8的调控作用,作者使用两种SMAD1/5/8抑制剂LDN193189和palovarotene处理了PCTK1-KD HT-29细胞。数据显示,这两种抑制剂都抑制了结直肠癌细胞的增殖和集落形成。然而,PCTK1 KD细胞对SMAD1/5/8抑制剂更为敏感。在存在SMAD1/5/8抑制剂的情况下,控制组和PCTK1 KD细胞的增殖差异在48小时内逆转,并且集落形成的减少在SMAD1/5/8抑制剂处理后也更高(图7A、B)。此外,LDN193189和palovarotene还有效地逆转了PCTK1-KO细胞对IRI-5-FU治疗的化疗耐药性(图7C)。总的来说,作者的数据表明,PCTK1通过BMPR1B-SMAD1/5/8信号通路抑制了结直肠癌细胞的增殖、CSC特性和化疗反应。通过药物抑制BMPR1B-SMAD1/5/8信号通路可以逆转PCTK1敲除对结直肠癌细胞恶性表型和化疗耐药性的促进作用。
总结
作者发现沉默BMPR1B逆转了PCTK1-KO细胞中细胞增殖、CSC特性和化学耐药性的增强。Smad1/5/8抑制剂、LDN193189和帕洛伐替尼治疗降低了PCTK1-KD和PCTK1-KO细胞中的癌症恶性肿瘤和化疗耐药性。总之,作者的研究结果表明,PCTK1通过下调CRC中的BMPR1B–Smad1/5/8信号通路,抑制癌症进展并改善化学反应。