提示:文章写完后,目录可以自动生成,如何生成可参考右边的帮助文档
视网膜电图特征可以检测成人的抑郁状态和治疗反应:一种机器学习方法
- 摘要
- 1. 引言
- 2. 方法和材料
- 2.1 人口与伦理声明
- 2.2 入选标准、临床和生物学评估
- 2.3 实验方案
- 2.4 分析
- 2.5.统计分析
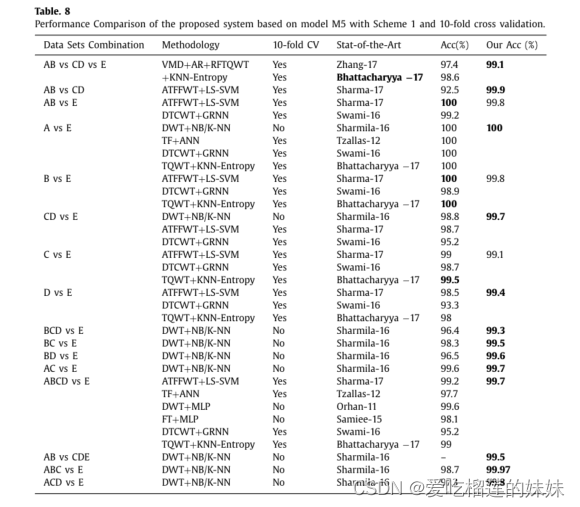
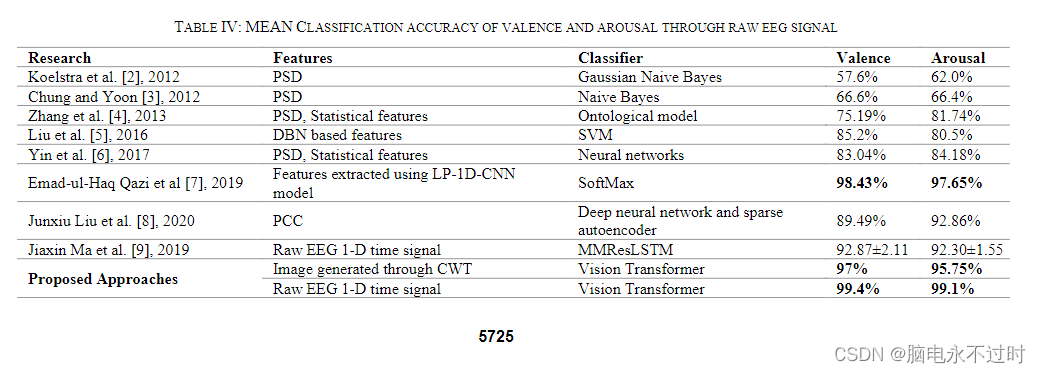
- 3. 结果
- 4.讨论

原文见链接:
https://www.sciencedirect.com/science/article/pii/S0165032722002646?via%3Dihub
摘要
背景:重度抑郁症(MDD)是一个主要的公共卫生问题。视网膜是间接研究大脑功能的相关部位。【视网膜电图(PERG)】显示MDD患者视网膜加工的改变。在此,研究了应用于PERG的信号处理和机器学习工具的相关性。
方法:根据国际视觉临床电生理学会(ISCEV)标准,在纳入的24名MDD患者和29名对照中进行PERG(其刺激为可逆棋盘)。患者每4周记录一次PERG,持续3个月。评估P50和N95的振幅和隐式时间。然后,基于小波分析从PERG时间序列中提取时间/频率特征。在此特征空间中学习了一个统计模型,并基于最小协方差行列式(MCD)mahalanobis距离导出了一个旨在量化MDD患者状态的度量。
结果:MDD患者在纳入时P50和N95内隐时间显著增加(分别为p=0006和p=00004,Mann–Whitney U检验)。从原始PERG中提取的拟议指标在纳入时提供了患者和对照之间的区别(p=00001)。在第12周随访结束时,对照组和患者提取的指标之间的差异不显著(p=0,07),反映了治疗的疗效。
结论:应用于PERG的信号处理和机器学习工具可以帮助临床决策MDD的诊断和随访,以测量治疗反应。
1. 引言
重度抑郁症(MDD)是一个常见的公共卫生问题,它涉及全球3亿人,具有快速的动力学(Smith,2014)。它是全球残疾的主要原因,对生活质量有显著影响,死亡率较高,也是自杀的主要危险因素之一。高达30%的MDD患者对其抗抑郁治疗没有反应,50-60%的患者没有达到足够的反应(Fava,2003;Smith,2014)。
MDD的诊断和治疗非常具有挑战性。目前还没有客观的工具来帮助医生进行诊断以及评估和预测治疗反应,以调整患者的个性化和个性化治疗。MDD的诊断目前通过医学访谈进行。在本次访谈中,临床医生可以通过主观量表(如汉密尔顿抑郁评定量表(HRSD;HAM-D))获得帮助,但这些工具取决于患者的贡献(Bagby等人,2004)。目前还没有有效可靠的工具可以帮助抑郁症患者选择抗抑郁药及其有效剂量。对于精确精神病学,迫切需要在鉴别诊断的情况下改进诊断,检测患者亚组或特定症状(如自杀意念),以预测患者的更好治疗方法。
神经精神研究目前面临的挑战之一是开发新的调查方法,辅以机器学习等处理和分析,以找到可靠、客观、可重复、易于实施且独立于治疗师和患者的工具。在此背景下,电生理学技术是相关的和有前景的测量(Cosker等人,2020;Lavoie等人,2014b;London等人,2013;Schwitzer等人,20152017b)。据我们所知,只有一项研究将机器学习应用于MDD的脑电图(EEG)(Rajpurkar等人,2020)。在这项研究中,基于决策树的机器学习算法被应用于EEG数据以及治疗前症状评分,以根据药物治疗来分离MDD人群。EEG的机器学习和判别分析被证明有助于根据抑郁症的主要症状和治疗前脑电图的特征来预测抗抑郁药的疗效。
视网膜被认为是间接研究神经精神疾病中大脑功能的关键和相关部位(Bubl等人,2010a;Lavoie等人,2014a;London等人,2013;Schwitzer等人,2017b)。视网膜是中枢神经系统(CNS)的解剖和发育延伸,由特定神经元构成的复杂神经网络组成,并通过突触相互连接(Hoon等人,2014)。视网膜神经元与脑神经元具有相似的解剖和功能财产(Hoon等人,2014)。它们以膜电位和动作电位的形式发出电信号,例如大脑神经元。它们被赋予了几种复杂的神经传递信号通路,包括在大脑中检测到并参与MDD病理生理学的相同通路——血清素、多巴胺和谷氨酸,等等(Hoon等人,2014)。在许多神经精神疾病中,视网膜功能发生改变,涉及不同的病理生理机制,如神经传导异常、炎症和神经变性,这表明在这些疾病中观察到的大脑异常可以在视网膜水平上检测到(Lavoie等人,2014b,2014a;London等人,2013;Schwitzer等人,2015)。例如,抑郁症、精神分裂症、帕金森氏病、阿尔茨海默氏病和药物使用障碍等疾病的视网膜加工受损(Bernardin等人,2017年;Cosker等人,2021、2020年;London等人,2013年;Lucas等人,2018年;Schwitzer等人,2021、2019年、2016年;Youssef等人,2019年)。视网膜功能很容易获得,视网膜电生理测试相对容易实现,快速、廉价且无创(Bach等人,2013)。
在所有视网膜神经元阶段中,神经节细胞层被认为与间接研究大脑功能最相关(Schwitzer等人,2017b)。视网膜神经节阶段是视网膜的最后阶段,也是最完整的阶段,它通过神经节细胞轴突形成的视神经在视网膜和大脑之间起着解剖和功能中继的作用。这些细胞由细胞体、轴突和树突组成,并以动作电位(如脑神经元)的形式提供反应。在许多神经、精神和神经退行性疾病中,神经节细胞的功能发生改变。视网膜神经节细胞的电活动反应通过模式视网膜电图(PERG)记录,这是一种电生理技术(Bach等人,2013)。PERG测量使用棋盘刺激,例如视觉诱发电位(VEP)来记录源自中央神经元的电信号。PERG测量已经允许MDD患者和健康受试者的分化、对治疗的反应以及与VEP的相关性,这表明视觉视网膜神经节细胞和皮质功能是相关的(Bubl等人,2015,2012,2010b)。视网膜和PERG典型轨迹的示意图如图1所示。
因此,本研究提出的假设是,PERG指标的提取可能是反映潜在神经元细胞生物学中一系列功能和行为变化的间接测量。本研究的目的是评估PERGin MDD患者和对照组的P50和N95的振幅和内隐时间,并确定PERG在使用信号处理和机器学习技术诊断和评估MDD治疗反应中是否持有相关信息。
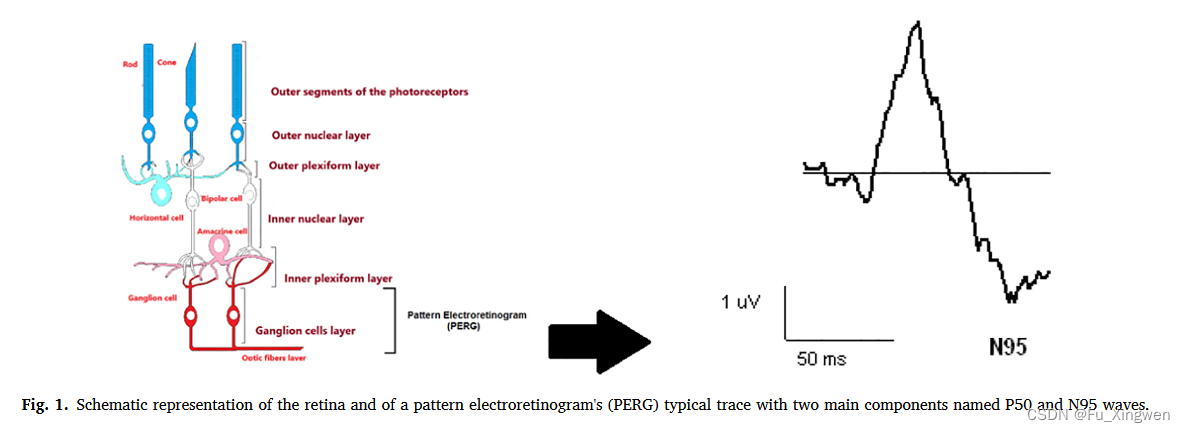
图1。视网膜和模式视网膜电图(PERG)典型轨迹的示意图,其中两个主要成分分别为P50和N95波。
2. 方法和材料
2.1 人口与伦理声明
MDD患者(n=24)从住院或未住院的精神病患者中招募,并通过医生的文件或建议定期随访精神科医生。数据收集时间为2019年1月16日至2019年12月31日。匹配的健康对照组(n=29)是从另外两个队列中招募的:CAUSA MAP研究(NCT02864680),他们是通过2014年2月11日至2016年6月30日的特别新闻活动在普通人群中招募的;以及ERICA研究(NCT0381897),他们是通过2019年3月1日至2021 4月30日的一次特别新闻宣传活动在普通人群中招募的。在参与本研究之前,MDD患者提供了详细的病史和治疗(当前和过去),接受了全面的精神病评估(迷你国际神经精神访谈-Mini、蒙哥马利-阿斯伯格抑郁评分量表-MARS、Epworth嗜睡量表-ESS、HAMILTON-a、匹兹堡睡眠质量指数-PSQI)和认知评估,并签署了详细说明研究各个方面的同意书。MDD参与者在研究结束时获得了15欧元的礼品券形式的补偿。该研究方案符合《赫尔辛基宣言》的要求,并获得了南锡大学医院伦理委员会的批准。这项初步研究是一个更大的项目LUMIDEP的一部分,该项目正在评估MDD患者的完整视网膜功能和结构,MDD患者接受积极的光治疗和照常治疗或安慰剂光治疗和正常治疗。
2.2 入选标准、临床和生物学评估
抑郁症组的主要入选标准是根据DSM IV标准诊断为重度抑郁症,并通过迷你国际神经心理访谈(Mini)测试进行评估。其他入选标准是收到关于临床试验的完整信息并签署书面知情同意书。所有参与者年龄在18至60岁之间,除抑郁和焦虑障碍外,DSM-IV轴I无精神障碍;无季节性紊乱;没有先前或当前的强光治疗;不缺乏精神科医生的随访;没有自杀风险。他们不应患有视网膜疾病或神经疾病,不应参加另一项研究(包括排除期),不应残疾,不应怀孕或哺乳,不应因司法或行政决定而被剥夺自由,不应在胁迫下接受精神病治疗,不应为研究以外的目的而进入卫生或社会机构,成为受法律保护措施(监护、监护、维护正义)约束的成年人,或无法表示同意。所有科目都包含在社会保障范围内。
健康对照受试者的纳入标准与CAUSAMAP研究的纳入标准相同,如之前的研究(Dartois等人,2021;Polli等人,2020;Schwitzer等人,2020、2018、2017a)和ERICA研究(NCT0381897)所述。
所有人在眼科评估中表现正常,包括视力和眼底镜检查。重要的是,所有参与者的每只眼睛用Moneyer量表测量的视力至少为10/10。没有参与者报告有视觉症状。如果参与者根据酒精使用障碍识别测试(AUDIT)中的分数报告酒精依赖,他们将被排除在研究之外。迷你国际神经心理访谈(Mini)用于评估当前和过去的精神疾病和药物使用史。
2.3 实验方案
PERG根据国际视觉临床电生理学会(ISCEV)标准进行(Bach等人,2013)。我们使用MonPackONE系统(Metrovision,Peérenchies,法国)进行刺激和记录。我们同时收集了两只眼睛的电信号。从每只眼睛获得平均视网膜反应。通过放置在结膜囊底部的DTL(Dawson Trick Litzkow)电极,在未扩张的瞳孔上收集电信号。接地电极和参比电极固定在前额和外眦。黑白对比双面棋盘,0.8◦ 检查尺寸、93.3%的对比度、100cd/m2的恒定亮度白色区域和4秒的反转。参与者被安置在离屏幕一米的地方。对于患有屈光障碍的参与者,提供了适当的视力矫正。每个参与者至少记录了220次响应,室内环境照明恒定,以达到最佳信噪比。在入选(n=24)、第4周(n=16)、第8周(n=13)和第12周(n=14)采用相同方案进行PERG。对左眼和右眼的平均响应进行平均,所分析的信号包含视觉刺激瞬间周围16ms至195.6ms之间的240个样本(采样率1024Hz)。在每次就诊时,患者完成MADRS、MADRS自我和HAMILTON量表。
2.4 分析
PERG数据使用眼科监视器(Metrovision,法国佩伦奇斯)进行分析。在典型的PERG轨迹上通常描述两种主要成分:一种是电正性成分P50,其次是电负性成分N95。N95被认为反映了视网膜细胞的反应。P50反映视网膜神经节细胞和黄斑光感受器的反应,用于评估黄斑功能。两个主要参数来自P50和N95,称为振幅,以微伏(μV)为单位测量,以及隐式时间,以毫秒(ms)为单位。从N95的谷到P50的峰测量N95的振幅。P50振幅是从不恒定N35的波谷或从基线到P50的峰值测量的。隐式时间表示达到最大N95和P50振幅所需的时间。除了对这些众所周知的特征进行分析之外,我们还考虑了基于小波分解的信号的更全局分析,包括对信号的时间/频率分析,将信号动力学的主要特征总结为几个系数。对这些系数应用了特征选择,以仅保留具有最高分辨力的系数,这里定义为具有与正态分布最大不同的分布(Lilliefors检验)。最后,通过主成分分析(PCA),我们减少了这个系数空间,以保留保留大部分能量(即大部分信息)的成分。保留了两个分量,并在该二维空间中定义了基于控制数据估计的最小协方差行列式(MCD Mahalanobis)的马氏距离。对于每个PERG采集,计算该距离(在左眼/右眼平均后)。补充材料中提供了这些不同方法步骤的更多细节。
2.5.统计分析
根据分析中包含的定量变量的非参数分布,适当时使用了曼-惠特尼U检验和Chisquare检验。α风险为0.05%。使用IBM SPSS Statistics 22.0(IBM公司)进行统计分析。补充材料中给出了基于小波分解的信号分析的更多细节。
3. 结果
纳入时和随访期间参与者的人口统计、药物使用、临床和PERG数据如表1所示。入选时,对照组和抑郁症患者在性别(p<0.05)、年龄(p<0.05)和受教育年限(p<0.05)方面存在差异,但在酒精使用方面,两组之间没有观察到相关差异(每周平均饮酒量p=0.78,AUDIT评分p=0.46)。MDD患者的P50和N95内隐时间显著增加(分别为p=0006和p=00004;Mann–Whitney U检验)。MADRS异质性评估、MADRS自我评估和汉密尔顿抑郁量表的得分在第12周和入选之间显著降低(分别为p=00002;00005和000001,Mann–Whitney U检验)。
我们的模型和导出的MCD Mahalanobis距离基于在所选特征空间中投影的控制数据的多变量正态性假设。该假设的有效性已使用Mardia的多变量正态性检验进行了评估,考虑了控制数据分布的偏度(针对小数据进行校正,p=0,16)和峰度(p=0,84)。因此,H0正态假设不能在0.05风险水平下被拒绝,这两个统计数据证实了所提出模型的有效性。
建议的MCD Mahalanobis距离也能够区分纳入时的对照组和患者(p=00002)(图2)。第4周和第8周的距离会随着治疗的进展而减少,但与对照组相比仍有显著差异(分别为p=00029和p=00021)(图2)。在第12周,与对照组相比,治疗的这一阶段没有发现显著差异(p=0.23)(图2)。我们将从PERG数据中提取的这一距离与入选时以及第4、8和12周收集的MADRS/MADRS自身数据进行了比较。参与者的得分明显高于第4周(MADRS的p=00078,MADRS自身的p=00197),随后在第8周和第12周,抑郁评分急剧下降至轻度至不存在(得分分别低于15分和10分,入选和第8周与第12周之间MADRS分别为p=00002和p=00001;MADRS自身为p=00014和p=00005)(图3)。
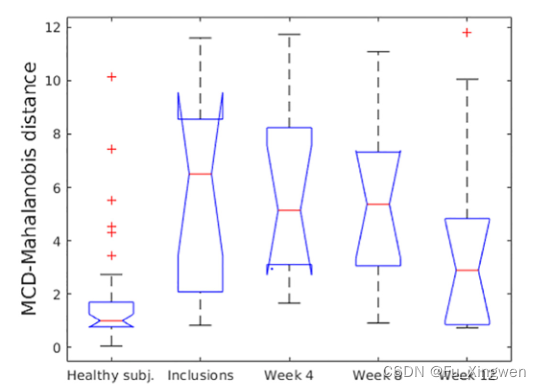
图2。沿着治疗的4个阶段追踪MCD Mahalanobis距离。直到第8周,分布几乎没有变化,第12周的下降幅度更大(虽然没有统计学意义,p>0.05)。第4周和第8周入选时,健康对照组和患者之间的差异显著(p<0.01),但健康对照组与第12周之间的差异不显著(p>0.05)。
————————————————————————————
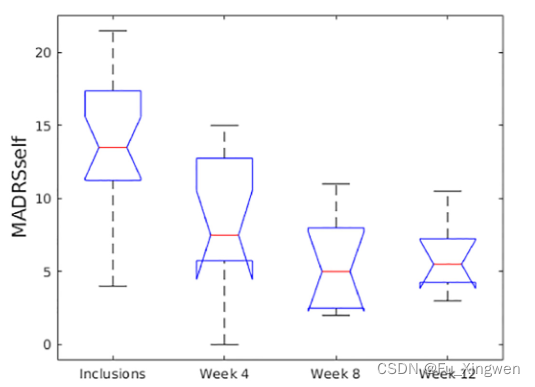
图3。与接下来的步骤相比,MADRS自我评分明显更高(p<0.05),然后在第8周和第12周急剧下降至轻度至不存在的抑郁评分(评分分别低于15和10),并在第4周过渡。
4.讨论
在这里,我们观察到:1-MDD患者在纳入时PERG的P50和N95内隐时间增加。借助机器学习算法和MCD Mahalanobis距离,2-PERG可以帮助区分健康人群和MDD受试者人群。3-PERG也可用于评估治疗期间MDD的病程。事实上,随着治疗进展,MCD Mahalanobis距离趋于减小,并随着病情缓解而恢复正常。在接受了12周治疗并观察到MADRS客观化的抑郁症状消退的MDD患者中,MCD Mahalanobis距离减少,在第12周患者和对照组之间没有显著差异。4-通过MADRS量表评估的MDD临床特征和通过人工智能算法分析的PERG评估的视网膜电生理财产具有相似的演变,表明主观和客观测量是相互关联的。
通过机器学习技术分析的PERG可以帮助区分健康人群和MDD人群,这一事实非常有前景,因为诊断构成了MDD的真正前景。诊断MDD相对容易。然而,鉴别诊断(例如双相抑郁症)以及抑郁症亚组的识别仍然是关键的观点。我们的发现为解决这些问题开辟了道路。在年轻人中,一些精神疾病可能与MDD有相似的症状,但不接受相似的治疗,导致对患者的护理不足。在没有病史的年轻人中,要绝对肯定地确认第一次抑郁发作是否与抑郁症或双极化障碍有关,确实很复杂。先前的研究支持了我们的发现,并已经强调了视网膜电生理学在精神疾病鉴别诊断中的有用性(Håebert等人,2020)。
在这项研究中,作者显示了150名精神分裂症患者和151名双相情感障碍患者的闪光ERG(fERG)记录的相似性和显著差异。在这两种疾病中,他们观察到锥体a波振幅降低,b波潜伏期延长,混合棒锥体a波和b波振幅降低。有趣的是,仅在精神分裂症患者中检测到锥体b波振幅降低。总之,这些发现支持精神障碍具有特定的视网膜特征。在这种情况下,机器学习的帮助可以增强这些发现的准确性和可靠性。照顾患者的另一个关键观点是及早发现高危对象。MDD一旦安装,会对患者的生活质量产生非常负面的影响,支持高危受试者的早期发现、客观和干预。先前的一项研究使用生活质量享受和满意度问卷(Q-LES-Q)对319名抑郁症患者的抑郁症状严重程度、功能和生活质量(QOL)之间的相互作用进行了详细分析(Ishak等人,2013)。
作者表明,抑郁症患者的生活质量显著受损,该研究人群的Q-LES-Q平均得分为39.8%(SD=16.9),而社区平均值为78.3%。例如,Håebert等人(2010年)研究了29名无需药物治疗的受试者的fERG,这些受精神分裂症或双相情感障碍影响的多代家庭的后代,在疾病出现最初症状前几年(Heåbert等人,2010年)。
在这些受试者中,他们观察到棒状b波Vmax振幅的减小,锥形波振幅的降低趋势,以及Vmax时棒状b波隐时间的延长趋势。患有精神分裂症、双相情感障碍或抑郁症的成年患者的fERG杆和锥体异常反应也有报道。我们假设在精神分裂症或双相情感障碍的受试者中观察到的一些ERG异常会出现在有风险的年轻受试者身上,并且ERG异常与神经发育有关。Gagnåe等人比较了精神分裂症、双相情感障碍或抑郁症患者的99个后代的fERG和223个健康对照组的fERR(性别和年龄平衡)(Gagnåe等人,2020)。
与健康对照组相比,后代的fERG表现为锥体b波潜伏期增加、棒b波振幅减少和棒b波潜伏期延长。如前所述,患有精神分裂症、双相情感障碍或抑郁症的成年患者的fERG棒和锥反应具有相似的特征,并且可以在遗传高危后代中检测到(Gagneået al.,2015;H eåbert et al.,2020)。这些结果为使用ERG检测患有精神障碍的受试者的早期电生理特征提供了可能性。未来的研究将在机器学习的帮助下,将人工智能算法应用于ERG测量,以增强视网膜测量在检测患有精神障碍的患者群体中的能力。
在MDD中,医生面临药物治疗的部分或无反应。一个目标是根据每个患者的症状、疑似神经递质缺陷等特征,找到最适合的个性化药物治疗。在MDD中,药物治疗是一项耗时数周的长期治疗,需要根据患者的反应和疾病的阶段进行定期调整。目前,它已根据患者声称的症状和治疗师发现的症状进行调整。因此,治疗调整仍然是高度主观的。风险在于减少治疗剂量,降低疗效的机会。相反,在抑郁状态得到缓解的同时,给予高剂量治疗以及治疗时间过长,会增加副作用的风险。在这方面,视网膜功能给出了有趣的指标。Håebert等人在100名MDD患者(其中17名无药物)和100名健康对照中记录了fERG(Håibert等人,2017)。在无药物的患者中观察到Vmax时锥A波和b波振幅的显著降低,而在药物患者中不存在。这些结果提示服药患者ERG参数可能正常化。这些有希望的发现有助于ERG在后续药物治疗和疗效评估中的相关性。这一点得到了以下事实的支持:视网膜被赋予了复杂的神经传递信号通路——血清素能、多巴胺能等——这些通路被中枢神经系统中的抗抑郁药靶向,我们显示了类似的结果,这表明借助机器学习算法分析的PERG测量可以将治疗过程中的MDD受试者与早期疾病中的健康受试者或抑郁受试者分开。
这项研究具有局限性,并暗示了几个观点。我们的结果是从少量受试者的初步分析中提取的。需要对大量受试者和抑郁症患者亚组进行进一步调查,以获得综合统计数据,并总结该技术对抑郁症诊断和治疗反应评估的相关性。MDD患者使用烟草不会影响N95内隐时间(Dartois等人,2021)。各组之间的性别和年龄差异不足以解释在患者中观察到的P50和N95的变化,因为性别似乎不参与PERG调节,且各组之间的年龄差异相对较低,无法解释本文中的结果(Celesia等人,1987年;Corîci等人,2015年;Porciatti等人,1992年)。这些测量和信号分析应在其他神经精神病理状况中复制——双相情感障碍、精神分裂症、神经退行性疾病、自闭症谱系障碍——以提高这些测量在诊断主要神经精神障碍中的敏感性和特异性。该技术还应能够帮助临床医生对特定病理状况进行鉴别诊断,如单极和双极抑郁症的鉴别诊断。在这里,患者接受了不同类型的治疗,我们评估了整体治疗的疗效,而不是单独治疗的疗效。在未来的研究中,需要使用特定和单独治疗的不同亚组患者来评估该技术在评估每种治疗的反应中的相关性。
在常规临床评估中,这些措施还应能够检测出会产生治疗耐药性的患者,以便在早期调整药物治疗。这种技术将来应该能够检测和分离应答者和非应答者患者。最后,为了在临床实践中使用,这些措施应易于使用、可移动、自动进行远程分析,并可用于门诊中心和位于偏远地区的中心,而不仅仅适用于特定的护理中心。