对于癌症治疗,耐药性的发生很大程度上限制了各类药物对癌症的临床有效性。例如,激酶抑制剂vemurafenib, erlotinib 和 crizotinib,分别对有BRAF突变的黑色素瘤,EGFR突变或ALK移位的肺腺癌有临床疗效。大部分患者对此治疗方法有反应,肿瘤缩小或是病情稳定。然而,临床数据表明,以上抑制剂在六至十二个月内会出现不同程度的耐药性,阻碍了长期治疗的成功性。
之前的研究已经证实,这种耐药性并不依赖于基因突变,而是有部分肿瘤细胞本身就存在逃避机制,在面对治疗的时候选择性地休眠。这种逃避机制可能是多个靶点共同作用的结果。最近的一项研究,实验人员即选取了谷胱甘肽过氧化物酶 4(GPX4)作为目标探索了对抗肿瘤耐药性的方法。
研究动态
旧金山分校的 Matthew Hangauer 博士和他的团队,用大剂量拉帕替尼处理乳腺癌细胞系BT474,比较存活了9天的耐药株细胞和未处理的细胞株之间基因活性的差异,他们发现,耐药株细胞有较高水平的典型间充质细胞(构成骨、软骨、肌肉、脂肪细胞)基因活性,但在细胞抵御氧化压力的某些必要基因上不活跃。
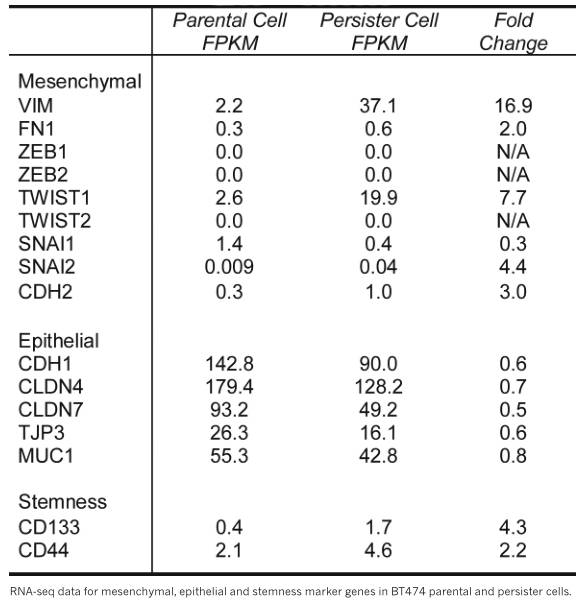
图1. 耐药株细胞间充质标志物显著上调(图片来源《Nature》)
由于间充质细胞中谷胱甘肽过氧化物酶4(GPX4)相对活跃,研究人员考虑是否耐药株的生存能力也来自于GPX4?将耐药株细胞的GPX4敲除之后,它们确实表现出了对氧化物的高敏感性。进一步使用一系列铁富营养化合物(强氧化性)处理这些细胞,可以导致它们迅速死亡。这一发现顿时为解决癌细胞耐药性的问题点亮了新的希望。

图2. GPX4抑制剂导致的铁富集,加速细胞氧化死亡(图片来源《Nature》)
通过对其他类型肿瘤细胞的试验,实验人员惊喜地发现:GPX4抑制剂在所有的肿瘤中都有效。这些结果表明,结合肿瘤的靶向治疗与GPX4抑制剂消除耐药株细胞的能力,可能是在多种人类癌症中预防复发的一个非常有前途的方法。但与多种药物的联合治疗往往导致毒副作用增加,可能会危害患者的安全性和治疗效果。Hangauer博士用另外一些实验证实:GPX4抑制剂大幅提升耐药癌细胞对氧化剂敏感性的特点,并不局限在短期内,可应用于靶向治疗或化疗完成一段时间之后。这种交错的治疗策略可能在临床上有益于最大化效力,同时最小化由两种药物同时联合治疗可能预期的潜在毒性增加。总之,针对GPX4的这项研究,提出了防止肿瘤复发的新策略。
参考文献:
[1] Matthew J. Hangauer,et al. Drug-tolerant persister cancer cells are vulnerable to GPX4 inhibition. Nature. 9 November 2017.
>>>>
文献使用产品
WEHI-539
WEHI-539 是一种选择性的 Bcl-XL 抑制剂,IC50 为 1.1 nM。