摘要:本文通过运用Discovery Studio中的CDOCKER方法,验证了α-Glucosidase 抑制剂与体外实验数据的一致性,并预测出槲皮素衍生物(compound 7)可以作为潜在α-Glucosidase 抑制剂的骨架分子并且具有治疗肥胖的作用。
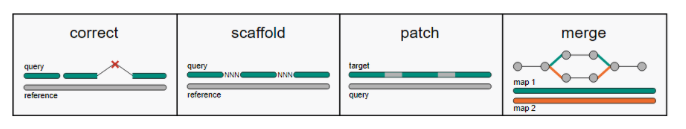
分子对接(molecular docking)是基于结构药物设计的核心模拟手段,依据受体与配体作用时的几何匹配和能量匹配过程,模拟受体-配体相互作用,预测两者间最佳的结合模式和结合亲和力。采用分子对接模拟技术,科研人员可以进行基于结构的药物虚拟筛选,药物分子的结构改造,药靶相互作用的机理研究等工作,从而大大提高实验效率。在Discovery Studio这一分子模拟的综合平台中,共有四种对接程序,包含Libdock、CDOCKER、FlexibleDocking,这三种对接算法各有优势,能够满足广大科研工作者的多种应用需求,为其提供配体受体间相互识别的“利器”。
基于分子对接与体外实验数据的一致性研究预测出槲皮素衍生物可以为α-Glucosidase 新的抑制剂
ref:Food & Function;IF=3.241
链接:DOI: 10.1039/C9FO01333D
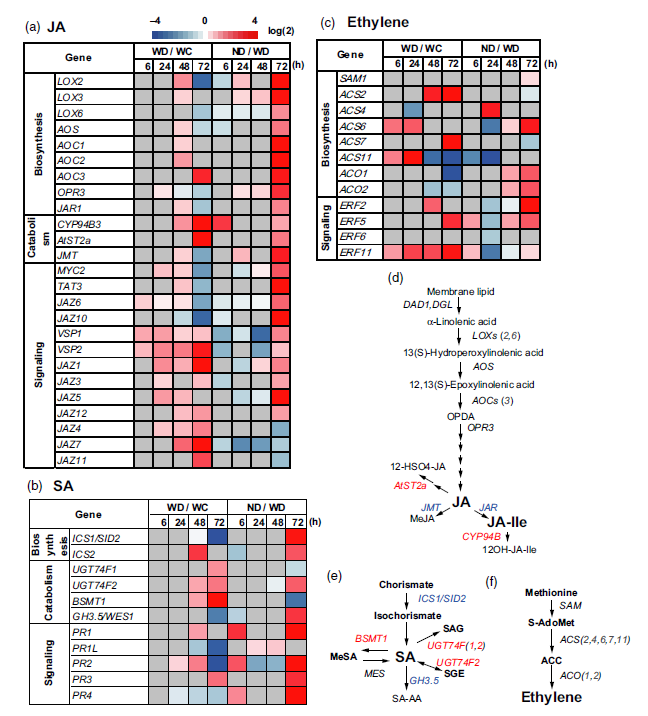
根据国际糖尿病联合会最新出版的糖尿病地图集,到2045年,估计将有6.29亿人受到糖尿病的影响;因此,控制糖尿病已成为食品科学和医学领域科学家的一项重要任务。α-Glucosidase(αG)主要负责释放葡萄糖低聚糖。血糖水平可以通过限制葡萄糖的吸收来控制,而葡萄糖的吸收可以通过减缓寡糖的水解来实现。因此,αG抑制剂已经被开发出来。化学合成的抑制剂有较强的副作用,越来越多的天然产物抑制剂成为研究的重点。多酚类物质普遍存在于植物种,它的一个重要功能就是抑制淀粉消化酶。本文通过运用Discovery Studio中的CDOCKER方法,验证了α-Glucosidase 多酚类抑制剂与体外实验数据的一致性,并预测出槲皮素衍生物(compound 7)可以作为潜在α-Glucosidase 抑制剂骨架分子并且compound 7具有治疗肥胖的作用。

图一 对接结果与体外数据的一致性评价
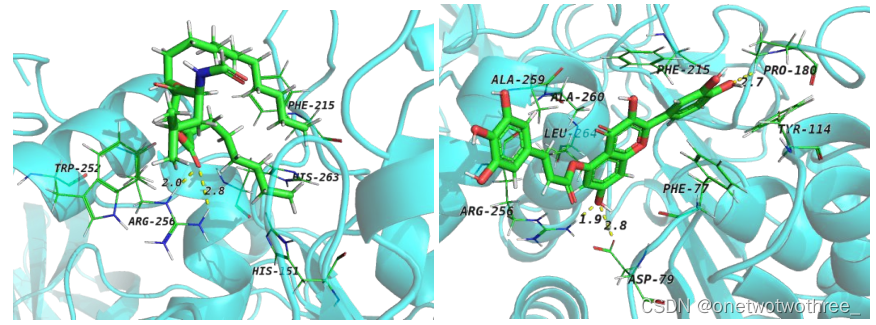
图三 奥利司他(左),compound7(右)与胰脂肪酶的结合模式
MaXFlow生物医药智能创新平台,由创腾科技自主研发,旨为不同领域的一线创新科技工作者提供一个合作共享的B-S架构平台。以“数据自由,模型自由”为理念,在结构模型与预测模型进行融合的基础上,实现模拟与AI需求的合并,为研发赋能。
![教程 | 规模化物种同源基因分析 - orthofinder [上篇]](https://img-blog.csdnimg.cn/img_convert/0d3225553fbefb5bcbef1fb39e9cf55e.png)